Бронхоальвеолярный лаваж (БАЛ) у собак и кошек
(с) Ветеринарный центр лечения и реабилитации животных «Зоостатус».
Варшавское шоссе, 125 стр.1.
Основные симптомы при коллапсе, воспалении дыхательных путей
Техника проведения бронхоальвеолярного лаважа
Бронхоальвеолярный лаваж – диагностическая процедура, заключающаяся во введении в бронхи и легкие пациента стерильного раствора, дальнейшем его удалении и исследовании клеточного состава полученного образца.
Для проведения диагностики используется бронхоскоп, таким образом врач получает возможность более детально оценить состояние дыхательных путей и взять анализ именно из поврежденного участка. Кроме того, БАЛ оказывает терапевтический эффект. У многих пациентов дыхательная функция после проведения процедуры значительно улучшается.
Показания
Бронхоскопия в сочетании с забором смывов часто используется в ветеринарной практике. Если бронхоскопия позволяет выявить степень воспаления, коллабирование дыхательных путей, бронхоэктазию, опухолевое поражение, то забор смывов дает возможность оценить характер воспаления (клеточный состав жидкости) и провести микробиологическое исследование (бактериальный посев с целью обнаружения возбудителя и определения его чувствительности к антибиотикам).
БАЛ показан при большинстве хронических и некоторых острых заболеваниях респираторного тракта.
Забор жидкости происходит из бронхов, бронхиол и альвеол пациента, таким образом, врач получает полную информацию о функционировании бронхов и легких.
Большая часть болезней нижних дыхательных путей имеет довольно схожую симптоматику. Только по данным физикального обследования (прослушивание легких, осмотр пациента) врач не может поставить точный диагноз. Рентгенография легких позволяет выявить воспаление бронхов, оценить степень поражения, но выяснить, какой природы патологический процесс, с ее помощью не представляется возможным.
Следовательно, БАЛ дает возможность разграничить инфекционную, аллергическую и опухолевую проблемы. Также метод крайне информативен при длительных инфекционных бронхитах, поскольку позволяет сразу подобрать подходящий препарат (антибиотик), который будет максимально эффективно воздействовать на возбудителя (как правило, на момент исследования животное уже лечилось несколькими препаратами).
Заболевания, при которых показано проведение БАЛ:
- хронический бронхит собак и кошек (бактериальной, паразитарной природы);
- эозинофильная бронхопневмония собак;
- астма кошек;
- пневмония;
- опухолевое повреждение бронхов, легких.
Симптомы непроходимости дыхательных путей
Техника проведения бронхоальвеолярного лаважа
Исследование проводится только под общей анестезией, занимает немного времени (порядка 10 минут). Является абсолютно безболезненной процедурой, хотя некоторые животные могут испытывать небольшой дискомфорт после забора смывов. Как правило, клиническая картина заболевания после БАЛ улучшается (интенсивность кашля снижается, дыхание становится значительно лучше).
Образцы, полученные при смыве, характеризуются хорошим качеством, цитологическая оценка отличается высокой точностью. В норме у пациентов в образце смыва должны преобладать альвеолярные макрофаги. При бронхиальной астме и паразитарных бронхитах выражена эозинофилия, при инфекционных бронхитах – нейтрофилия. При опухолевом процессе можно обнаружить неопластические клетки.
Стерильный раствор заливается в расчете 0,5 мл на кг веса пациента и немедленно аспирируется назад. Хорошим результатом является получение 50% объема обратно. Оставшаяся часть быстро всасывается слизистой дыхательных путей.
В течение минут после проведения процедуры осуществляется особенно тщательный мониторинг пациента на предмет цианоза слизистых, респираторного дистресса.
Пациент очень быстро приходит в себя и возвращается владельцу в тот же день.
Результаты цитологического и микробиологического исследований готовятся в течение рабочих дней.
Бронхоальвеолярный лаваж является очень информативным исследованием, позволяющим точно поставить диагноз и быстро подобрать оптимальное лечение вашему питомцу.
Источник
Видео
БРОНХОАЛЬВЕОЛЯРНЫЙ ЛАВАЖ ПОКАЗАНИЯ. ТЕХНИКА. ОСЛОЖНЕНИЯ
Автор (ы): С.К. Собакина, П.В. Белокопытов, А.Н. Лапшин, С.Г. Атанасова, А.А. Иванова
Организация(и): Инновационный ветеринарный центр Московской ветеринарной академии
Журнал: №5 — 2018
Ключевые слова: бронхоальвеолярный лаваж, бронхоальвеолы, бронхоскопия. Key words: bronchoalveolar lavage, bronchoalveoli, bronchoscopy/
Сокращения: БАЛ – бронхоальвеолярный лаваж, ПАВ – поверхностно-активное вещество
Цель исследования: описать существующие техники проведения бронхоальвеолярного лаважа
Бронхоальвеолярный лаваж (БАЛ) – это минимально инвазивная техника, используемая в гуманной и ветеринарной медицине для отбора проб из бронхов нижнего порядка и альвеолярных пространств.
Отбор проб БАЛ используется для изучения врожденного, клеточного и гуморального клеточного ответа, обусловленного наличием популяции клеток, которые могут облегчить диагностику различных диффузных заболеваний легких.
Бронхоскопия и БАЛ могут предоставить диагностически ценную информацию в случаях воспалительных заболеваний дыхательных путей, бронхоэктазии, эозинофильной пневмонии, паразитарных заболеваний легких, бактериальной пневмонии, микотической пневмонии и неоплазии [1,2,3,16].
Bronchoalveolar lavage (BAL) is a minimally invasive technique utilized in human and veterinary medicine to sample the lower generation bronchi and alveolar spaces.
BAL sampling is used to study the congenital, cellular and humoral cellular response due to the presence of a cell population caused by the presence of a population of cells that can facilitate the diagnosis of various diffuse pulmonary diseases.
Bronchoscopy and BAL can provide definitive diagnoses in cases of inflammatory airway disease, bronchiectasis, eosinophilic pneumonia, pulmonary parasites, bacterial pneumonia, mycotic pneumonia and neoplasia.
Показанием для проведения БАЛ являются кашель, неясные или отсутствие изменений на рентгенограмме легких, несмотря на проявление клинических признаков, соответствующих заболеваниям респираторного тракта, новообразования легких, пневмония, стридор, удаление обструкции бронхиальной слизью.
Противопоказаниями к проведению БАЛ являются одышка (относительное противопоказание) и коагулопатия.
Есть несколько критериев, гарантирующих попадание раствора в нижние дыхательные пути (бронхоальвеолы): процент извлекаемой жидкости и наличие слоя ПАВ. [2]
Более высокий процент извлеченного раствора (около 50%) говорит об отборе проб из нижних дыхательных путей. Медиана извлеченного раствора у собак 42-48%, у кошек 50-75%. В свою очередь, небольшое количество извлеченной жидкости ( 3 колониеобразующих единиц на миллилитр характерно для наличия бактериальной бронхопневмонии. Во всех полученных образцах необходимо проводить анализ на наличие аэробов и микоплазм. Анализ на наличие грибков следует проводить в эндемических районах.
Сообщается об использовании ПЦР в диагностике видов Micoplasma, Bordetella bronchiseptica и Toxoplasma gondii. Результаты ПЦР должны быть интерпретированы с осторожностью в связи с тем, что Mycoplasma и Bartonella в норме могут присутствовать в ротоглотке у собак и кошек. Следовательно, положительные результаты не гарантируют того, что данные патогены вызывают текущие клинические признаки у пациента. К тому же отрицательный результат не исключает наличие инфекции. Несмотря на то, что микроорганизм может присутствовать в дыхательных путях, он может быть не представлен в небольшом образце, используемом для экстракции ДНК, в итоге получая ложно-отрицательный результат [5,7,8,9,12].
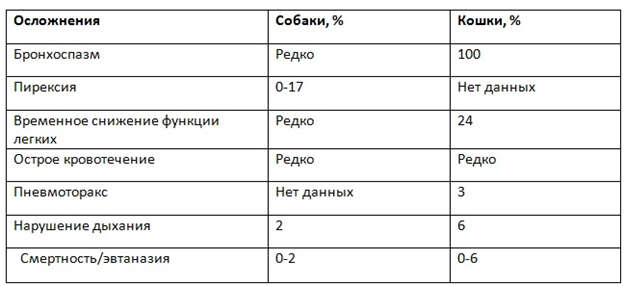
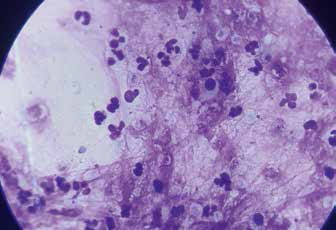
Цитология после проведения БАЛ
. 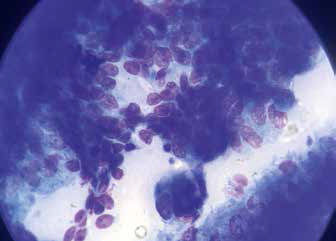
Рис. 7. Сегментоядерные нейтрофилы и альвеолярные Рис. 8. Реснитчатый респираторный эпителий
макрофаги на фоне слизи
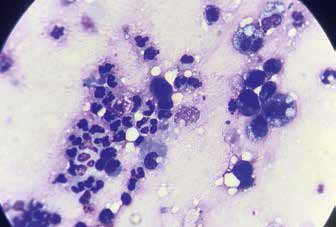
Рис. 9. Сегментоядерные нейтрофилы на фоне Рис. 10. Конгломерат клеток эпителия
розового межуточного вещества – слизи
Диагностическое значение данной процедуры не должно быть переоценено, потому что пациенты с заболеваниями дыхательных путей имеют повышенные риски, связанные с анестезией и респираторными процедурами. Риск проведения процедуры всегда должен быть оценен с точки зрения ожидаемых результатов. Также, как показывают исследования, БАЛ при сопровождении бронхоскопии имеет меньшее количество осложнений и большую диагностическую ценность полученных образцов. Выбор методики также может быть сделан на основании материальной базы ветеринарного учреждения, но в любом случае выполнение БАЛ должно быть регламентировано технически и выполнено подготовленными специалистами.
1. Carol R. Reinero, DVM, PhD, Diplomate ACVIM (Internal Medicine), University of Missouri–Columbia. Bronchoalveolar Lavage Fluid Collection Using a Blind Technique.
2. Standardization of Bronchoalveolar Lavage Aspiration Techniques to Optimize Diagnostic Yield of Canine Lower Respiratory Tract Samples by Katharine Sarah Woods.
3. Mills PC, Lister AL. Using urea dilution to standardize cellular and non-cellular components of pleural and bronchoalveolar lavage (BAL) fluids in the cat. J. Fel. Med. Surg. 2006; 8:105-110. Mordelet-Dambrine M., Arnoux.
4. Melamies MA, Jarvinen AK, Seppala KM, Rita HJ, Rajamaki MM. Comparison of results for weight-adjusted and fixed-amount bronchoalveolar lavage techniques in healthy Beagles. Am. J. Vet. Res. 72:694–698, 2011.
5. Chalker VJ, Owen WM, Paterson C, et al. Mycoplasmas associated with canine infectious respiratory disease. Microbiology 150:3491–3497, 2004.
6. Creevy KE. Airway evaluation and flexible endoscopic procedures in dogs and cats: laryngoscopy, trans-tracheal wash, tracheobronchoscopy, and bronchoalveolar lavage. Vet Clin North Am Small Anim Pract 2009; 39:869-880
7. Spector D, Wheat J, Beamis D, Rohrbach B, Taboada T, Legendre AM. Antigen testing for the diagnosis of Blastomycosis. J Vet Intern Med 20:711–712, 2006.
8. Egberink H, Addie D, Belak S, et al. Bordetella bronchiseptica infections in cats. J Fel Med Surg 11:610–614, 2009.
9. Anfray P, Bonetti C, Fabbrini F, Magnino S, Mancianti F, Abramo F. Feline cutaneous toxoplasmosis: a case report. Vet Dermat 16:131–136, 2005.
10. American Thoracic Society. Bronchoalveolar lavage guidelines. Jul 8, 2012.
11. Hawkins EC, Berry Cr. Use of a modified stomach tube for bronchoalveolar lavage in dogs. J Am Vet Med Assoc 1999; 215(11):1635-1638.
12. Hawkins EC, Davidson MG, Meuten DJ, et al. Cytologic identification of Toxoplasma gondii in bronchoalveolar lavage fluid of experimentally infected cats. J Am Vet Med Assoc 1997; 210(5):648-650.
13. Hawkins EC, DeNicola DB. Cytologic analysis of tracheal wash specimens and bronchoalveolar lavage fluid in the diagnosis of mycotic infections in dogs. J Am Vet Med Assoc 1990a; 197(1):79-83.
14. Hawkins EC, DeNicola DB, Kuehn NF. Bronchoalveolar lavage in the evaluation of pulmonary disease in the dog and cat: state of the art. J Vet Intern Med 1990b; 4:267-274.
15. Hawkins EC, DeNicola DB, Plier ML. Cytological analysis of bronchoalveolar lavage fluid in the diagnosis of spontaneous respiratory tract disease in dogs: a retrospective study. J Vet Intern Med 1995; 9:386–392.
16. Johnson LR, Drazenovich TL. Flexible bronchoscopy and bronchoalveolar lavage in 68 cats (2001–2006). J Vet Int MEd 2007; 21:219–225.
17. Silverstein DC, Drobratz KJ. Clinical evaluation of the respiratory tract. In: Ettinger SJ, Feldman EC, eds. Textbook of veterinary internal medicine. 7th ed. Saunders Elsevier: St Louis, 2010:1055–1066.
18. Yoneda KY, Morrissey BM. The technique of adult flexible bronchoscopy: part 1. J Respir Dis 2008; 29(11):423-428.
19. Hawkins EC. Bronchoalveolar lavage. In: King LG, ed. Textbook of respiratory disease in dogs and cats. Saunders Elsevier: St Louis, 2004:118-128.
20. Cooper ES, Schober KE, Drost WT. Severe bronchoconstriction after bronchoalveolar lavage in a dog with eosinophilic airway disease. J Am Vet Med Assoc 2005; 227 (8):1257- 1262.
21. Johnson LR, Queen EV, Vernau W, et al. Microbiologic and cytologic assessment of bronchoalveolar lavage fluid from dogs with lower respiratory tract infection: 105 cases (2001-2011). J Vet Intern Med 2013;27(2):259-267.
22. Kirschvink N, Leemans J, Delvaux F, et al. Bronchodilators in bronchoscopy induced airflow limitation in allergen-sensitized cats. J Vet Intern Med 2005;19:161-167.
23. Padrid PA. Laryngoscopy and tracheobronchoscopy of the dog and cat. In: Tams TR, Rawlings CA, eds. Small Animal Endoscopy. St. Louis, MI: Elsevier Mosby, 2011:331- 359.
24. Fluoroscopic-Guided Bronchoalveolar Lavage (F-Bal) for Sampling the Lower Airways of Cats Hooi KS1, Defarges A1 , Nykamp S1, Weese S2, Bienzle D2. Departments of Clinical Studies1 and Pathobiology2, University of Guelph, ON.
Источник
Бронхоальвеолярный лаваж у кошек техника



| |||||
Здравствуйте!
Патогены могли не вырасти по многим причинам — это зависит и от техники взятия смыва, от самой среды и условий в лаборатории и тд.
По цитологии нельзя исключить полностью ни астму, ни опухоль.
Все же улучшение на преднизолоне и отсутствие эффекта от антибиотиков + длительный кашель без ухудшения общего состояния говорят в пользу астмы.
Поговорите с Вашим доктором о применении ингаляционных стероидов с помощью прибора Аэрокет.
Здравствуйте!
Боюсь, что по интернету мы не сможем помочь разобраться в этой ситуации, здесь нужен лечащий врач. Из того, что еще могу Вам сказать:
1) СОЭ не очень информативный анализ у животных. В нашей клинике мы его не выполняем
2) Белок в моче может повышаться по разным причинам, это также не является маркером воспаления в бронхо-легочной системе
3) По поводу гнойно-воспалительной этиологии — надо понимать что есть гнойно-воспалительная этиология? Были обнаружены бактерии? И откуда были взят материал?
4) Сомнительно, что на преднизолоне кашель инфекционной природы будет проходить и, при отмене, вновь возобновляться, даже учитывая его противовоспалительное действие
5) Если антибиотики применялись в достаточной дозе и достаточным курсом, то, учитывая разные группы применяемых антибиотиков, маловероятно, что они не работали
6) Ингаляционные стероиды — это лучший вариант, тк. ингаляции не оказывают такого выраженного системного действия как таблетки или инъекции преднизолона
Источник

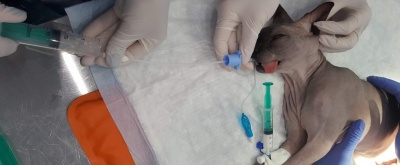




 Бронхоальвиолярный лаваж при диагностики кашля
Бронхоальвиолярный лаваж при диагностики кашля