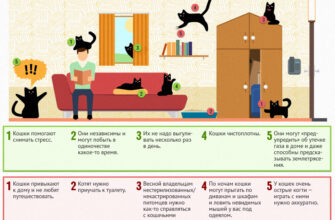
Цистит у животных.
Цистит у животных.
В ветеринарной практике цистит это наиболее часто встречаемое заболевание.У животных это заболевание связано с прониканием инфекции из почек или мочевыводящих путей.
Е. coli (кишечная палочка). В ряде исследований доказано,что у животных воспалительный процесс в мочевом пузыре может быть вызван Е.coli.Определенную роль в возникновении бактериального цистита у собак играют некоторые хронически протекающие незаразные болезни ,такие как сахарный диабет.Из научных данных из 158 собак с сахарным диабетом 12,7%животных,преимущественно самок,выявлен бактериальный цистит с преобладанием штамма E.coli.В настоящее время фактор вирулентности кишечной палочки,приводящее к развитию воспалительного процесса в органах мочевыводящей системы у животных хорошо изучены.В частности изучены ФВ(фактор вирулентности) кишечной палочки,как S-фимбрии,афимбральной адгезии,S-гемолизин,аэробактин и цитотоксический некротизирующий фактор 1-го типа ассоциированы с ее уропатогенным штаммом.
Другие микроораганизы обитающие на поверхности слизистых оболочек домашних животных,при определенных условиях могут стать причиной развития воспалительного процесса.Микроорганизмы такие как Corynebacterium urealyticum ,обладая тропностью к органам мочевыделительной системы,могут обусловить развитие воспалительного процесса в мочевом пузыре.Mycoplasma canis выделена в моче собак с рецидивирующей ИМП,резистентной к антибиотикотерапии и сопровождающейся простатитом,эпидедемитом и циститом.В моче также встречаются и микроорганизмы рода Candida tropicalis.
Патогенез .Развитие воспалительного процесса в мочевом пузыре у собак связано с участием целого ряда эндогенных биологически активных веществ-ферментов,специфических белков и цитокинов.ЦОГ-2(циклооксигеназа-2)представляет собой фермент ,принимающий участие в цикле трансформации арахидоновой кислоты в простагландины.В организме животных ЦОГ-2 непосредственно участвует в реализации воспалительных процессов и оказывает промоторное действие факторам роста новобразований.В настоящее время выявлен повышенный уровень экспрессии ЦОГ-2 при плоскоклеточном раке мочевого пузыря у животных.В патегенезе воспалительного процесса в мочевом пузыре немаловажную роль играют цитокины-эндогенные полипептидные медиаторы межклеточного взаимодействия.В настоящее время известно более 200 представителей семейства цитокинов.Наибольшее внимание уделено изучению ИЛ-6 и ИЛ-8,принимающие участие в реализации воспаления в мочевом пузыре.ИЛ-6 является ранним «противовоспалительным»цитокином,быстро экспрессируемым в ответ на воздействие ФВ бактерий и вирусов многими типами клеток,участвующими в регуляции и воспалении иммунного ответа:Т-лимфоцитами,моноцитами,макрофагами,клетками эндотелия и эпителия мочевыводящих путей.ИЛ-8 относится к семейству хемокинов,чьи функции связаны с регуляцией миграции различных типов иммунокомпетентных клеток,в частности с организацией хемотаксиса лейкоцитов в очаг воспаления.
Диагностика .При нормальном состоянии Белок мочи/Креатинин у животных это соотношение не привышает 0,4;у собак с воспалительным процессом в мочевом пузыре через 72-96 ч после введения в мочевой пузырь микроорганизмов наблюдается статическое повышение Бм/Креатинин от 1.5 до 40.8.Показатель Белок мочи/Креатинин рассматривается как диагностический тест не только при патологии функции почек,но и при нарушениях функции мочевыделительной системы.Метод УЗИ инфомативен в диагностике эмфизематозного воспаления,а также на предмет взвеси в мочевом пузыре.УЗИ может быть результативно в диагностике полипов,новообразований мочевого пузыря.При выявлении новообразований необходимо тщательное цитологическое/гистологическое исследование.Гарантированное подтверждение наличия или отсутствия бактерий и их идентификация возможна только при бактериологическом исследовании.Однако в моче в норме может содержаться небольшое количество бактерий,происходящих из нижней трети уретры,поэтому только установление фактора(роста колоний при посеве мочи на специальных средах) присутствия бактерий (бактериурии)недостаточно для постановки диагноза инфекции мочевыводящих путей.Достоинство бактериологического метода состоит в том,что оно,помимо установления вида микроорганизма,позволяет определить и количество бактерий.При получении чистой культуры спектр антибактериальных препаратов ,к которым определяется чувствительность,зависит от выделенного вида микроорганизма.
Источник
Формы хронического цистита
Сокращения: ИМП – инфекция мочевыводящих путей, МП – мочевой пузырь, ГАК – гиперадренокортицизм, ХБП – хроническая болезнь почек, НПВС – нестероидные противовоспалительные препараты, ГКС – глюкокортикостероиды.
Цистит – наиболее распространенная патология нижних отделов мочевыводящих путей. В своей практике ветеринарный врач встречается с различными формами циститов: поверхностными, интерстициальными, полипоидными, эмфизематозными, некротизирующими и другими.
Чаще всего у собак и кошек возникают бактериальный цистит, стерильный интерстициальный (идиопатический) цистит и контактный цистит (обычно на фоне присутствия уролитов в мочевом пузыре). Наиболее опасными считаются бактериальные циститы, так как они могут приводить к самым тяжелым последствиям.
Бактериальный цистит происходит на фоне колонизации бактериями нижних отделов мочевыводящих путей. Организм обладает рядом защитных механизмов, препятствующих проникновению бактерий в мочевой пузырь и их закреплению на слизистой оболочке (табл. 1). Инфекционный процесс развивается при нарушении одного или нескольких механизмов защиты. В редких случаях высоковирулентные патогены могут преодолевать неповрежденные защитные механизмы.
Факторы риска развития ИМП
Воспаление состоит из нескольких этапов: повреждение, удаление поврежденных тканей и повреждающих агентов, пролиферация (заживление).
После повреждения тканей происходит вазодилатация. В результате замедляется скорость кровотока в участке воспаления, возникает экссудация плазмы, протеина, фибриногена и клеточных элементов в межклеточное пространство. Продукция цитокинов и хемокинов клетками воспаления регулирует силу воспалительного процесса, нейтрофилы осуществляют фагоцитоз и выделение лизосом в экссудат, что приводит к локальному повреждению тканей.
Фаза восстановления начинается в ранний период и заканчивается только после полного устранения воспалительного агента. В эту фазу происходит восстановление базальной мембраны, осуществляется реэпителизация участков с незначительным повреждением тканей, крупные дефекты закрываются соединительной тканью (фиброзируются).
Если в острую фазу не удается устранить источник повреждения тканей, происходит хронизация процесса.
Хроническое воспаление характеризуется протеканием двух конкурентных процессов: клеточной инфильтрацией и фиброплазией в попытке изолировать и элиминировать этиологический фактор.
Если устранить воспаление не удается, этиологический фактор изолируется различными путями, в том числе путем «заключения» в коллаген, продуцируемый фибробластами. Со временем соединительная ткань подвергается разрастанию, развивается фиброз. Таким образом, в мочевом пузыре формируется так называемый гиперпластический цистит, клиническим проявлением которого является образование полипов на стенке пузыря.
В гуманной медицине описано несколько этапов прогрессирования гиперпластического цистита (рис. 2):
- Полипоидный цистит (нормальный или гиперплазированный уротелий, выраженный воспалительный отек собственной пластинки слизистой оболочки).
- Папиллярный цистит или фиброэпителиальный полип (гиперплазия уротелия, выраженный фиброз).
- Буллезный цистит (выраженный отек собственной пластинки).
Лечение
Поскольку наиболее важной причиной развития хронического цистита является нарушение защитных механизмов мочевыводящей системы, основной задачей терапии становится их восстановление.
Достигается это в первую очередь за счет устранения основного повреждающего фактора, чего зачастую бывает достаточно при лечении острых циститов. Если же речь идёт о хроническом процессе, важной задачей становится создание условий, при которых восстановление защитных механизмов становится возможным. Это достигается за счет прекращения воздействия повреждающего фактора на достаточное для восстановления время (этим, в частности, обусловливается длительная антибиотикотерапия при лечении хронических уроциститов).
Краеугольным камнем лечения ИМП является антибиотикотерапия. Подбор антибиотика у пациента с хроническим бактериальным уроциститом осуществляется исключительно на основании бактериологического посева мочи, взятой методом цистоцентеза. Антибиотикотерапию проводят от 14 дней до 6 месяцев, иногда дольше, если в ближайшее время после окончания курса антибиотика наблюдался рецидив бактериального уроцистита. В подобном случае наряду с антибиотикотерапией обязательно проводится дополнительная диагностика, направленная на выявление факторов, предрасполагающих к развитию инфекции (структурные аномалии, иммуносупрессия и т. д.).
Необходимо помнить, что при значимом повреждении стенки микрофлора может меняться на устойчивую к применяемому на данный момент антибиотику даже в процессе антибактериального лечения. В связи с этим у хронических пациентов рекомендуется контролировать стерильность мочи как в процессе терапии, так и после ее окончания.
Контроль стерильности мочи при проведении антибиотикотерапии нужно осуществлять:
- через 3–5 дней от начала приема антибиотика;
- ежемесячно во время применения антибиотиков;
- перед окончанием курса антибиотикотерапии;
- через 5–7 дней после окончания антибиотикотерапии.
Основное внимание при лечении хронической ИМП стоит уделять коррекции предрасполагающих факторов – как структурных, так и метаболических.
Для коррекции стерильного гиперпластического цистита применяются стероидные или нестероидные противовоспалительные препараты. Автор статьи в качестве терапии первой линии обычно использует такие НПВС, как Мелоксикам или Робенакоксиб, с длительностью курса 14–21 день. Кортикостероиды применяются автором в случае неэффективности НПВС из-за более выраженных побочных действий ГКС.
При уролитиазе часто достаточной мерой считается удаление уролитов, хотя иногда остаточный гиперпластический цистит требует терапии антибиотиками или противовоспалительными препаратами. Краеугольным камнем терапии при этом является спектральный анализ уролита, позволяющий проводить терапию, направленную на профилактику рецидивирования.
Сложной задачей для клинициста может стать лечение уроцистита, сопровождающегося некрозом слизистой оболочки мочевого пузыря. Многим подобным пациентам необходимо проводить цистотомию с последующим удалением некротизированной и инкрустрированной слизистой оболочки, так как она является резервуаром для инфекции. Не проведенная вовремя операция может привести к рецидивирующей обструкции уретры, а иногда и к тотальному некрозу стенки мочевого пузыря. Однако некоторые пациенты полностью выздоравливают при проведении адекватной антибиотикотерапии. В связи с этим, пожалуй, самой сложной задачей является принятие решения о необходимости проведения цистотомии у пациентов с некрозом слизистой оболочки.
Отдельного внимания заслуживает коринебактериальная инфекция. Данные микроорганизмы часто имеют высокую устойчивость к антибактериальным препаратам. Иногда при подтитровке антибиотиков выявляется отсутствие чувствительности ко всем представленным агентам. В таком случае антибиотиком выбора является ванкомицин, дающий хорошие клинические результаты при лечении инфекции, вызванной Corynebacterium urealyticum.
Поддерживающая терапия
Эффективность поддерживающей терапии при лечении хронических уроциститов является спорной, так как большинство методов не имеет доказанной эффективности. Однако ведение пациентов с тяжелыми рецидивирующими уроциститами нередко становится трудной задачей для врача.
В подобных случаях могут использоваться следующие методы поддерживающей терапии:
- Коррекция предрасполагающих метаболических и структурных нарушений (эпизиопластика при наличии рецессии вульвы у сук).
- Избегание (по возможности) катетеризаций уретры, проведения уретростомии у собак.
- Увеличение объема потребляемой животным жидкости.
- Закисляющие препараты (экстракт клюквы).
- Пробиотики.
- Омега жирные кислоты.
- D-манноза.
- Обработка наружных половых органов растворами антисептиков.
Результаты лечения:
- Разрешение клинических признаков, посев мочи стерильный. Так происходит в большинстве случаев.
- Клинические признаки разрешаются, а затем возвращаются. Положительный посев мочи:
- А. Реинфекция, новые бактерии (инфекция по причине нарушения защитных механизмов).
- Б. Рецидив или хроническая инфекция:
- Та же бактерия с той же чувствительностью (антибиотик неэффективен):
- Организмы могут сохраняться в биопленках.
- Антибиотики не достигают микроорганизмов.
- Те же организмы с приобретенной устойчивостью.
- Та же бактерия с той же чувствительностью (антибиотик неэффективен):
- В. Суперинфекция – предыдущие организмы уничтожены, но появились новые.
- Клинические признаки сохраняются (с положительным или отрицательным культивированием):
- А. Неверный диагноз (стерильное воспаление).
- Б. ИМП наслоилась на новообразование.
- В. Суперинфекция.
Список литературы:
Источник
Инкрустирующий цистит (случай из практики и обзор литературы)
© И. А. Корнеев, А. А. Люблинская
Кафедра урологии Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова
Инкрустирующий цистит представляет собой хроническое воспаление мочевого пузыря, сопровождающееся солевой инкрустацией его слизистой, вызываемой расщепляющими мочевину бактериями. Представлен случай из практики и обзор литературы.
Ключевые слова: инкрустирующий цистит.
Инкрустирующий цистит относится к редко встречающимся заболеваниям, при котором на фоне хронического воспаления мочевого пузыря наблюдается формирование на поверхности его слизистой оболочки пластов из выпавших в осадок солей. Доказано, что ведущую роль в развитии клинических проявлений этого заболевания играют микроорганизмы, расщепляющие мочевину, наиболее распространенными из которых являются Corinebacteria spp. До настоящего времени опубликовано небольшое количество работ, посвященных этому заболеванию, преимущественно случаев из практики. В связи с этим особенности диагностики и выбора лечебной тактики у больных инкрустирующими циститами изучены недостаточно полно. Представляем собственное наблюдение.
Больная К. 77 лет поступила в клинику урологии СПБГМУ им. акад. И. П. Павлова с жалобами на учащенное болезненное мочеиспускание и примесь крови в моче. Впервые гематурия появилась за 3 месяца до поступления на фоне приема антикоагулянтов после эндопротезирования тазобедренного сустава и была купирована гемостатиками. В удовлетворительном состоянии была выписана домой из стационара, к урологу не обращалась до момента поступления. Сопутствующие заболевания: сахарный диабет 2-го типа, болезнь Паркинсона, дисциркуляторная энцефалопатия, диабетическая полиневропатия, железодефицитная анемия.
При обследовании выявлена щелочная реакция мочи, выраженная примесь крови и солей, лейкоциты — до 5 в поле зрения. В посеве мочи выявлен Streptococcus spp. в диагностически значимом титре 5 × 10 5 КОЕ/ мл. При цитологическом исследовании осадка мочи опухолевые клетки не обнаружены. При УЗИ в полости мочевого пузыря определяются гиперэхогенные образования. При цистоскопии в области треугольника Льето и нижней полуокружности мочевого пузыря определяется покрытая фибрином и инкрустированная мелкими конкрементами слизистая оболочка, которая была резецирована трансуретрально в пределах здоровых тканей. При гистологическом исследовании обнаружены фрагменты слизистой оболочки с участками хронического воспаления в фазе обострения и обширными зонами деструкции с диффузной лейкоцитарной инфильтрацией. Послеоперационный период протекал гладко, на вторые сутки был удален уретральный катетер, больная была выписана в хорошем состоянии для амбулаторного динамического наблюдения.
При повторном обследовании спустя шесть месяцев после операции больная жалоб не предъявляла, клинико-лабораторные показатели — в пределах границ нормальных значений, в посеве мочи роста патогенных микроорганизмов не определено.
Несмотря на то, что наиболее частыми возбудителями инкрустирующего цистита являются микроорганизмы Corinebacterium Urealiticum группы D2 [1, 2, 4, 8–13, 15, 20, 21, 23, 24, 26, 29, 30, 32–35, 37–40], доказано, что это заболевание может быть вызвано Nanobacteria [18], E. coli [20], Ureaplasma urealyticum [14]. Corinebacterium Urealiticum — грамм-положительный сапрофитный микроорганизм кожи. По мнению большинства специалистов, для развития инкрустирующего цистита необходимо наличие предрасполагающих факторов, снижающих противомикробную резистентность организма. К ним относятся пожилой возраст пациентов [1, 26, 37], иммуносупрессивная терапия, в том числе и после органной трансплантации [4, 23, 32, 37], а также перенесенные травматические повреждения мочевого пузыря [13], эндоскопические оперативные вмешательства и лучевое воздействие на его стенку [8, 28, 30, 33]. Установлено, что инкрустирующий цистит чаще встречается у мужчин [1, 37], может сопровождать метапластическую и неопластическую трансформацию уротелия мочевого пузыря [5, 27].
Наиболее распространенными симптомами заболевания являются гематурия [2, 17, 21, 26, 27], боли над лоном в покое и при мочеиспускании, отхождение мелких конкрементов с мочой [25], недержание мочи [21]. При длительном течении может наблюдаться анемия [21], снижение емкости мочевого пузыря, вовлечение в процесс инкрустации верхних мочевых путей с развитием инкрустированного пиелита, атаками пиелонефрита, и присоединением хронической почечной недостаточности.
Диагностика инкрустирующего цистита основана на интерпретации анализов мочи, в которых обычно определяется гематурия, лейкоцитурия, кристаллурия в совокупности с визуализацией инкрустированной солями слизистой мочевого пузыря. При бактериологическом исследовании возможно выделение возбудителя, однако в ряде случаев роста микроорганизмов на средах не наблюдают [2, 21, 26], что может быть обусловлено необходимостью посева мочи на специальные среды. Для идентификации возбудителя (Corinebacterium Urealitycum) необходимо выполнить посев мочи на кровяной агар овец [6]. На обзорной цистограмме у ряда больных визуализируются тени, соответствующие расположению инкрустированных фрагментов стенки мочевого пузыря.
Несмотря на то, что для лечения больных инрустирующим циститом предложены разнообразные подходы, до настоящего времени нет единого мнения о наиболее эффективной методике. Большинство авторов рекомендуют применение антибактериальной терапии с учетом чувствительности выделенных при посеве мочи микроорганизмов препаратами фторхинолонового ряда, гликопептидов, полусинтетических пенициллинов (ципрофлоксацин, офлоксацин, норфлоксацин, ванкомицин, тейкопланин, амоксициллин) [12, 15, 30, 33, 35, 36, 38]. Кроме того, рекомендовано использование инстилляций кислыми растворами ренацидина (лимонно-кислотная смесь), солита, ацетогидроксаминовой кислоты [3, 8, 15, 19, 22, 25, 26, 32, 33]. Однако длительное течение хронического воспалительного процесса в мочевых путях способствует формированию штаммов, резистентных к действию антибактериальных средств.
Кроме того, возбудители инкрустирующего цистита способны образовывать устойчивые к антибактериальному воздействию пленки на поверхности сформировавшихся в процессе их жизнедеятельности конкрементов и, таким образом, способствовать созданию патологического порочного круга факторов, предрасполагающих к затяжному течению процесса.
Возможности применения хирургического лечения при инкрустирующем цистите изучены недостаточно полно. Описаны случаи успешного применения трансуретральной [2] и открытой [27] резекции пораженной слизистой мочевого пузыря, которыми можно дополнить лечение при отсутствии эффекта от консервативной терапии.
Таким образом, диагностика и лечение инкрустирующего цистита не имеют определенной тактики и требуют дальнейшего изучения и усовершенствования.
Описанный нами случай — доказательство успешной диагностики и лечения данного заболевания.
Список литературы
1. Aguado J. M., Ponte C., Soriano F. Bacteriuria with a multiply resistant species of Corynebacterium (Corynebacterium group D2): an unnoticed cause of urinary tract infection // J. Infect. Dis. 1987. Vol. 156 (1). P. 144–150.
2. Aguado J. M., Morales J. M., Salto E. et al. Encrusted pyelitis and cystitis by Corynebacterium urealyticum (CDC group D2): a new and threatening complication following renal transplant // Transplantation. 1993. Vol. 56(3). P. 617–622.
3. Arrizabalaga M., Extramiana J., Mora M. et al. Alkaline encrusted cystitis: factors affecting prognosis // Actas. Urol. Esp. 1991. Vol. 15(5). P. 474–476.
4. Audard V., Garrouste-Orgeas M., Misset B. et al. Fatal septic shock caused by Corynebacterium D2 // Intensive. Care. Med. 2003. Vol. 29 (8). P. 1376–1379.
5. Berney D. M., Thompson I., Sheaff M., Baithun S. I. Alkaline encrusted cystitis associated with malakoplakia // Histopathology. 1996. Vol. 28 (3). P. 253–256.
6. De Briel D., Langs J. C., Rougeron G. Multiresistant corynebacteria in bacteriuria: a comparative study of the role of Corynebacterium group D2 and Corynebacterium jeikeium // J. Hosp. Infect. 1991. Vol. 17 (1). P. 35–43.
7. Cano Sánchez A., Sánchez Montón T., Gil Rueda B. et al. Alkaline encrusted cystitis secondary to Proteus mirabilis infection in a HIV infected patient // An. Med. Interna. 1997. Vol. 14(1). P. 33–34.
8. Chung S. Y., Davies B. J., O’Donnell W. F. Mortality from grossly encrusted bilateral pyelitis, ureteritis, and cystitis by Corynebacterium group D2 // Urology. 2003. Vol. 61(2). P. 463.
9. Estorc J. J., de La Coussaye J. E., Viel E. J. et al. Teicoplanin treatment of alkaline encrusted cystitis due to Corynebacterium group D2 // Eur. J. Med. 1992. Vol. 1(3). P. 183–184.
10. Fariña Pérez L. A., Menéndez P., Astudillo A. et al. Encrusted alkaline cystitis and malacoplakia // Actas. Urol. Esp. 1999. Vol. 23 (10). P. 885–887.
11. Fernández Natal M. I., García Díez F., Salas Valién J. S. et al. Incrusted cystitis with isolation of Corynebacterium group D2 // Med. Clin. (Barc). 1992. Vol. 98(11). P. 419–422.
12. García Bravo M., Aguado J. M., Morales J. M. et al. Corynebacterium urealyticum in kidney transplant patients // Med. Clin. (Barc). 1995. Vol. 104 (15). P. 561–564.
13. García Díez F., Fernández Natal I., Guerreiro González R., González del Valle C. Corynebacterium D2 as a ureolytic organism: report of 5 cases // Arch. Esp. Urol. 1991. Vol. 44(9). P. 1069–1072.
14. Giannakopoulos S., Alivizatos G., Deliveliotis C. et al. Encrusted cystitis and pyelitis // Eur. Urol. 2001. Vol. 39(4). P. 446–448.
15. Hertig A., Duvic C., Chretien Y. et al. Encrusted pyelitis of native kidneys // J. Am. Soc. Nephrol. 2000. Vol. 11(6): 1138–40.
16. Huguet Pérez J., Salvador Bayarri J., Vicente Rodríguez J. Encrusted cystitis. Is it always alkaline? // Arch. Esp. Urol. 1999. Vol. 52 (2). P. 157–164.
17. Ito M., Kanno T., Kawase N., Taki Y. Encrusted cystitis with ammonium acid urate calculi: a case report // Hinyokika. Kiyo. 2002. Vol. 48(4). P. 221–224.
18. Jelic T. M., Roque R., Yasar U. et al. Calcifying nanoparticles associated encrusted urinary bladder cystitis // Int. J. Nanomedicine. 2008. Vol. 3 (3). P. 385–390.
19. Khallouk A., Wallerand H., Kleinclauss F. at al. Conservative management of Corynebacterium urealyticum encrusted cystitis // Prog. Urol. 2006. Vol. 16(4). P. 496–498.
20. Lefi M., Touffahi M., Moussa A. et al. Encrusted cystitis // Prog. Urol. 2005. Vol. 15(6). P. 1138–1140.
21. Masson J. C., Charriere D., Masson J., Varini J. P. Corynebacteria D2 and encrusted cystitis with alkaline urine // Prog. Urol. 1992. Vol. 2(6). P. 1012–1017.
22. Meria P., Desgrippes A., Arfi C., Le Duc A. Encrusted cystitis and pyelitis // J. Urol. 1998. Vol. 160(1). P. 3–9.
23. Meria P., Margaryan M., Haddad E. et al. Encrusted cystitis and pyelitis in children: an unusual condition with potentially severe consequences // Urology. 2004. Vol. 64(3). P. 569–573.
24. Molina M., Ortega G., Ruiz J. et al. Corynebacterium D2-induced encrusted cystitis // An. Med. Interna. 1989. Vol. 6(12). P. 641–642.
25. Namsupak J., Headley T., Morabito R. A. et al. Encrusted cystitis managed with multimodal therapy // Can. J. Urol. 2008. Vol. 15 (1). P. 3917–3919.
26. Ohara H., Yoshimura K., Terada N. et al. Two cases of encrusted cystitis // Hinyokika. Kiyo. 2004. Vol. 50(1). P. 33–35.
27. O’Sullivan O., Clyne O., Drumm J. Encrusted cystitis — an unusual cause of recurrent frank haematuria // Ir. J. Med. Sci. 2006. Vol. 175(4). P. 74–75.
28. Parra Muntaner L., Rivas Escudero J. A., Gómez Cisneros S. et al. Bilateral obstructive uropathy secondary to encrusted cystitis. Report of a case // Arch. Esp. Urol. 1996. Vol. 49(8). P. 870–872.
29. Penta M., Fioriti D., Chinazzi A. et al. Encrusted cystitis in an immunocompromised patient: possible coinfection by Corynebacterium urealyticum and E. coli // Int. J. Immunopathol. Pharmacol. 2006. Vol. 19(1). P. 241–244.
30. Pierciaccante A., Pompeo M. E., Fabi F., Venditti M. Successful treatment of Corynebacterium urealyticum encrusted cystitis: a case report and literature review // Infez Med 2007. Vol. 15 (1). P. 56–58.
31. Romero Perez P., Amat Cecilia M., Omera Arbash A. R. et al. Encrusted cystitis. Review of the literature and report of a case // Actas. Urol. Esp. 1992. Vol. 16(6). P. 496–505.
32. Serrano-Brambila E., López-Sámano V., Montoya-Martínez G. et al. Encrusted prostatitis: case report and literature review // Actas. Urol. Esp. 2006. Vol. 30 (3). P. 321–323.
33. Soriano F., Ponte C., Santamaria M. Corynebacterium group D2 as a cause of alkaline-encrusted cystitis: report of four cases and characterization of the organisms // J. Clin. Microbiol. 1985. Vol. 21 (5). P. 788–792.
34. Soriano F., Ponte C., Santamaría M. In vitro and in vivo study of stone formation by Corynebacterium group D2 (Corynebacterium urealyticum) // J. Clin. Microbiol. 1986. Vol. 23(4). P. 691–694.
35. Soriano F., Rodriguez-Tudela J. L., Castilla C., Avilés P. Treatment of encrusted cystitis caused by Corynebacterium group D2 with norfloxacin, ciprofloxacin, and teicoplanin in an experimental model in rats // Antimicrob. Agents. Chemother. 1991. Vol. 35(12). P. 2587–2590.
36. Soriano F., Ponte C. A case of urinary tract infection caused by Corynebacterium urealyticum and coryneform group F1 // Eur. J. Clin. Microbiol. Infect. Dis. 1992. Vol. 11 (7). P. 626–628.
37. Soriano F., Tauch A. Microbiological and clinical features of Corynebacterium urealyticum: urinary tract stones and genomics as the Rosetta Stone // Clin. Microbiol. Infect. 2008. Vol. 14(7). P. 632–643.
38. Stewart R. G., Nowbath V., Carmichael M., Klugman K. P. Corynebacterium group D2 urinary tract infection // S. Afr. Med. J. 1993. Vol. 83 (2). P. 95–6.
39. Tauch A., Trost E., Tilker A. et al. The lifestyle of Corynebacterium urealyticum derived from its complete genome sequence established by pyrosequencing // J. Biotechnol. 2008. Vol. 136 (1–2). P. 11–21.
40. Vázquez V., Morales M. D., Serrano C. et al. Corynebacterium urealyticum in renal trasplantation. CT and sonography imaging characteristics of encrusted cistitis and pielitis // Nefrologia. 2004. Vol. 24(3). P. 288–293.
Encrusted cystitis (case report and review of literature)
Korneyev I. A., Lyublinskaya A. A.
Summary. Encrusted cystitis is a chronic inflammations of the bladder associated with mucosal encrustations induced by urea splitting bacteria. The case report and review of literature is presented.
Key words: encrusted cystitis.
Источник