- Инфекционный перитонит кошек — Feline infectious peritonitis
- СОДЕРЖАНИЕ
- Вирус и патогенез FIP
- Передача вируса
- Клинические признаки
- Вытекающий (влажный) FIP
- Не эффузивный (сухой) FIP
- Диагностика
- Диагностика эффузивного FIP
- Диагностика неэффективного FIP
- Противовирусные препараты
- Иммуностимуляторы
- Противовирусные препараты
- Противовоспалительные препараты
- Профилактика
- Вакцинация
- Профилактика
- В кино
- Инфекционный перитонит кошек. Рекомендации по лечению и профилактике Европейского консультативного совета по болезням кошек 2012
Инфекционный перитонит кошек — Feline infectious peritonitis
| Инфекционный перитонит кошек | |
|---|---|
 | |
| FIP-инфицированная почка, демонстрирующая воспалительную реакцию | |
| Специальность | Инфекционное заболевание |
| Симптомы | Начальная фаза: симптомы, похожие на простуду . |
Конечная фаза: одышка , недержание мочи , паралич .
Инфекционный перитонит кошек ( FIP ) — это название распространенного и аберрантного иммунного ответа на инфекцию коронавирусом кошек (FCoV).
СОДЕРЖАНИЕ
Вирус и патогенез FIP
FCoV — вирус желудочно-кишечного тракта. Большинство инфекций либо бессимптомны, либо вызывают диарею, особенно у котят, поскольку материнские антитела ослабевают в возрасте от 5 до 7 недель. Вирус представляет собой мутацию кишечного коронавируса кошек (FECV). Из кишечника вирус очень ненадолго проходит системную фазу, прежде чем вернуться в кишечник, где он выделяется с фекалиями.
Патогенез МФП является сложным. Существует общее мнение, что FIPV возникают в результате мутаций, позволяющих им более успешно проникать или реплицироваться в моноцитах (тип лейкоцитов). Однако многие аспекты взаимодействия вируса с хозяином, влияющие на болезнь, остаются неопределенными, например факторы, влияющие на форму болезни (влажная или сухая), исход (смерть или устойчивость) и восприимчивость хозяина.
Передача вируса
FCoV часто встречается в местах, где большие группы кошек содержатся вместе в помещении (например, питомники , приюты для животных и т. Д.). Вирус распространяется с фекалиями, и кошки заражаются при проглатывании или вдыхании вируса, обычно при совместном использовании поддонов для кошачьих туалетов или при использовании зараженных совков или щеток, передающих инфицированные микроскопические частицы наполнителя для кошачьего туалета неинфицированным котятам и кошкам. FCoV также может передаваться через различные жидкости организма. Вирус легко распространяется при прямом контакте между кошками. Наиболее распространенная форма распространения — через слюну, так как большинство кошачьих домов используют вместе миски с едой и водой. Еще одна важная форма распространения — это уход или борьба. Когда зараженная кошка ухаживает за здоровой кошкой, она оставляет зараженную слюну на шерсти. Позже, когда здоровая кошка идет ухаживать за собой, она проглатывает зараженную слюну, а затем заражается.
Клинические признаки
Существует две основные формы FIP: эффузивный (влажный) и невыполнительный (сухой). Хотя оба типа смертельны, эффузивная форма встречается чаще (60–70% всех случаев) и прогрессирует быстрее, чем невыполнительная форма.
Вытекающий (влажный) FIP
Отличительным клиническим признаком эффузивного FIP является скопление жидкости в брюшной полости или груди , что может вызвать затруднения дыхания. Другие симптомы включают отсутствие аппетита, лихорадку, потерю веса, желтуху и диарею.
Не эффузивный (сухой) FIP
Сухой FIP также будет проявляться отсутствием аппетита, лихорадкой, желтухой, диареей и потерей веса, но скопления жидкости не будет. Обычно у кошки с сухим ФИП наблюдаются глазные или неврологические признаки. Например, у кошки могут возникнуть трудности при вставании или ходьбе, и со временем она станет функционально парализованной. Потеря зрения — еще один возможный исход болезни.
Диагностика
Диагностика эффузивного FIP
Диагностика эффузивной формы заболевания в последние годы стала более простой. Обнаружение вирусной РНК в образце излияния (жидкости, слитой из организма), например, с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), является диагностикой эффузивного FIP. Однако для этого требуется, чтобы образец был отправлен во внешнюю ветеринарную лабораторию. В ветеринарной больнице есть ряд тестов, которые могут исключить диагноз эффузивного ФИП в течение нескольких минут:
- Измерьте общий белок в выпоте: если он меньше 35 г / л, вероятность FIP крайне мала.
- Измерьте соотношение альбумина к глобулину в выпоте: если оно больше 0,8, FIP исключен; если он меньше 0,4, FIP является возможным, но не определенным диагнозом.
- Изучите клетки в выпоте: если это преимущественно лимфоциты (тип лейкоцитов), то FIP исключается как диагноз.
Диагностика неэффективного FIP
Неэффективный FIP сложнее диагностировать, чем эффузивный FIP, потому что клинические признаки имеют тенденцию быть более расплывчатыми и разнообразными: поэтому список дифференциальных диагнозов намного длиннее. Неэффективный диагноз ФИП следует рассматривать при соблюдении следующих критериев:
- Анамнез: кошка молодая (до 2 лет), чистокровная: более 70% случаев FIP приходится на породистых котят.
- Анамнез: кошка пережила стресс, например, недавнюю стерилизацию или вакцинацию.
- Анамнез: у кошки была возможность заразиться FCoV, например, из племенного или спасательного питомника или недавнего появления в доме чистокровного котенка или кошки.
- Клинические признаки: кошка страдает анорексией или ест меньше обычного; похудел или не набрал вес; есть лихорадка неизвестного происхождения ; внутриглазные признаки; желтуха.
- Биохимия: гипергаммаглобулинемия ; повышение уровня билирубина без повышения уровня печеночных ферментов.
- Гематология : лимфопения ; нерегенеративная — обычно легкая — анемия .
- Серология : у кошки высокий титр антител к FCoV: этот параметр следует использовать с осторожностью из-за высокой распространенности FCoV в племенных и спасательных питомниках.
Нефузивный FIP может быть исключен как диагноз, если кошка серонегативна , при условии, что тест на антитела имеет отличную чувствительность. В исследовании, в котором сравнивались различные коммерчески доступные внутренние тесты на антитела к FCoV, FCoV Immunocomb (Biogal) оказался на 100% чувствительным; Быстрый иммунохроматографический тест Speed F-Corona (RIM) (Virbac) показал чувствительность на 92,4%, а тест на инфекционный перитонит кошек FASTest (MegaCor Diagnostik) — на 84,6%.
Поскольку FIP является иммуноопосредованным заболеванием , лечение делится на две категории: прямое действие против самого вируса и модуляция иммунного ответа.
Противовирусные препараты
Иммуностимуляторы
Иммуностимуляторы — это препараты, повышающие активность иммунной системы против вируса. Наиболее распространенными препаратами этого класса для лечения FIP являются рекомбинантный кошачий интерферон омега (Virbagen Omega, Virbac) или человеческий интерферон альфа-2b . Поскольку человеческая версия в конечном итоге становится мишенью иммунной системы как чужеродный антиген , кошачья версия кошачьего интерферона более эффективна.
Экспериментальный полипрениловый иммуностимулятор (ИП) произведен Sass and Sass и протестирован доктором Аль Лежандром, который описал выживаемость более 1 года у трех кошек с диагнозом FIP и леченных этим лекарством. В последующем полевом исследовании 60 кошек с неэффективным FIP, получавших ИП, 52 кошки (87%) умерли до 200 дней, но восемь кошек выжили более 200 дней от начала лечения ИП, а четыре из них выжили более 300 дней. .
Противовирусные препараты
Противовирусные препараты (в узком смысле) действуют, вмешиваясь в ферменты или другие биологические процессы вируса FIP.
Экспериментальный препарат под названием GS-441524 был использован в полевом эксперименте с 31 кошкой. Через 25 дней пять кошек умерли, восемь из них вылечились и впоследствии у них возник рецидив, а у 18 кошек не было никаких последующих рецидивов. Восемь рецидивов были снова подвергнуты лечению, некоторым были назначены более высокие дозы. Из этих восьми кошек одна умерла и семь вылечились, что означает, что 25 из 31 кошки в конечном итоге излечились от FIP. Хотя препарат еще (по состоянию на 2019 год) коммерчески недоступен в Соединенных Штатах, это исследование считается очень многообещающим и может привести к появлению коммерчески доступных лекарств для лечения FIP. GS-441524 коммерчески доступен с чистотой> 99% от поставщиков исследовательских химикатов, таких как Selleckchem , MedKoo и MedChemExpress .
Экспериментальный противовирусный препарат под названием GC376 был использован в полевых испытаниях на 20 кошках: у 7 кошек наступила ремиссия, а у 13 кошек начался ответ, но произошел рецидив, и они были усыплены. Этот препарат еще не поступил (по состоянию на 2017 год) в продажу.
Противовоспалительные препараты
Обычно рекомендуется использовать противовоспалительные препараты против FIP.
Иммунодепрессанты ослабляют иммунную систему, помогая уменьшить воспаление . В качестве иммунодепрессивного препарата при ФИП используется преднизолон , кортикостероид . Нет плацебо-контролируемых испытаний, показывающих, что преднизолон лучше других противовоспалительных средств.
Профилактика
Вакцинация
Эффективной вакцины против FIPV не существует. ДНК — вакцинация с плазмидами , кодирующими белки FIPV не дали иммунитет. Скорее было замечено, что антитела к белку шипа FIPV усугубляют заболевание.
Профилактика
Котята защищены от инфекции материнскими антителами до отъема, обычно в возрасте 5–7 недель; следовательно, можно предотвратить заражение котят, удалив их из источников инфекции. Однако FCoV — очень заразный вирус, и такая профилактика требует строгой гигиены.
В кино
Фильм 2018 года под названием Aeris Пола Кастро-младшего и Али Миллера с Фрэнком Дилом, Арабеллой Оз и Бетси Эйдем в главных ролях рассказывает о котенке , рожденном с FIP, который был приобретен в зоомагазине и двенадцать дней с ним владельцев. Фильм получил награду на кинофестивале Garden State 2018 в категории короткометражных повествований и стал обладателем Gold Kahuna на церемонии вручения премии Honolulu Film Awards 2018 .
Источник
Инфекционный перитонит кошек. Рекомендации по лечению и профилактике Европейского консультативного совета по болезням кошек 2012
Что нового?
Патогенез и эпидемиология инфекционного перитонита кошек (FIP) пока остаются предметом споров. Согласно одной гипотезы, в природе независимо циркулируют 2 типа коронавируса кошек (FCoV). Эта гипотеза не объясняет спорадическую, неэпидемическую встречаемость FIP. Другая гипотеза, согласно которой у индивидуальных кошек спонтанно возникают мутации при репликации, например, при иммуносупрессирующем стрессе, выглядит более правдоподобной.
Ее аргументы:
Функциональная экспрессия одного из неструктурных белков (3с) является решающей для репликации FCoV в кишечнике, но несущественной для системной репликации FIPV. У всех серопозитивных по FCoV 3с ген был неизменен, тогда как в >70 % случаев FIPV в нем были найдены мутации, но не в 100%, что свидетельствует в пользу того, что мутация в гене 3с, также не единственная причина развития инфекционного перитонита кошек.
3с-инактивированные вирусы не способны на репликацию, в редких случаях и только в кишечнике, что объясняет редкую встречаемость FIP заболевания.
Свойства вируса
Инфекционный перитонит кошек (FIP) вызывается в результате мутации коронавируса, возникающими у отдельных кошек. Коронавирус кошек (FCoV) принадлежит семейству Coronaviridae, порядку Nidovirales (de Vries etal, 1997). Эти вирусы являются шаровидными, сферическими, оболочечными, имеющими положительно направленную одну цепь РНК (Lai and Holmes, 2001). С геномом от 27 до 32 kb с четырьмя структурными белками (S для спайка, M для матрикса, N для нуклеокапсида и E для оболочки) и до четырех дополнительных неструктурных протеинов. Коронавирусы являются самыми большими из РНК-содержащих, известных к настоящему времени (Brown and Brierly,1995; deVries e tal, 1997). Биологически важной характеристикой этих вирусов является их способность подвергаться рекомбинации (Lai,1996; Lai and Holmes, 2001). Вместе с коронавирусом собак и вирусом трансмиссивного гастроэнтерита свиней FCoV принадлежит к I группе коронавирусов, что определяется антигенными и геномными особенностями.
Коронавирус кошек бывает 2 типов, что определяется антигенными и геномными свойствами. Вирус типа II FCoV является наиболее распространенным (Hohdatsu et al, 1992; Addie et al, 2003; Vennema, 1999; Kummrow et al, 2005; Shiba et al, 2007); менее распространены рекомбинанты между II типом и I типом FCoVs и коронавирусом собак, которые независимо возникают в естественных условиях (Herrewegh et al, 1998). Большинство исследований проведено на вирусах типа II, которые, в отличие от вируса I, могут размножаться в клеточной культуре (Pedersen etal, 1984). Важно, что оба вируса могут вызывать инфекционный перитонит кошек.
Ранее, штаммы FCoV было принято подразделять на 2 типа: кишечный и вирус инфекционного перитонита (FIPV; Pedersen, 1987). Однако, поскольку все FCoV могут вызывать системную инфекцию, что продемонстрировано в RT-PCR исследованиях, таких терминов необходимо избегать и они не будут использоваться в настоящем руководстве.
Кошачий коронавирус может выживать до 7 недель в сухих условиях окружающие среды (Scott, 1988) и имеет непрямую передачу, т.е. посредством контаминации лотков для экскрементов, обуви, рук и одежды. Однако FCoV легко инактивируется большинством моющих средств и дезинфектантов.
Эпизоотология
Коронавироз кошек встречается у домашних кошек повсеместно, к нему также могут быть серопозитивны и другие представители кошачьих. Инфекция чаще всего встречается при скученном содержании, в частности в питомниках, где серопозитивность может достигать 100% (Horzinek et al, 1979; Addieand Jarrett,1 992; Sparkes et al, 1992; Addie, 2000; Kummrowetal, 2005; Herrewegh et al, 1995; Foley et al, 1997; Kiss et al, 2000), в этих случаях чаще встречается и фатальный инфекционный перитонит кошек, до 12 % (Addie&Jarret, 1992; Fehr et al, 1995; Pedersen, 1995 b; EBM grade III). Распространённость заболевания будет зависеть от популяции кошек, возрастного распределения, и от условий обитания. Некоторые породы, например, бенгальские кошки чаще поражаются инфекционным перитонитом (Kissetal, 2000; Pesteanu-Somogyietal, 2006).
Возраст является наиболее важным фактором риска: 70% животных заболевших вирусным перитонитом младше 1 года (Rohrer et al, 1993; Hartmann, 2005. Возникновение инфекционного перитонита кошек происходит реже у кастрированных животных (Pesteanu-Somogyi et al, 2006). Поскольку любая форма стресса, подавляющего иммунную систему у серопозитивных по FCoV может привести к развитию FIP (хирургические вмешательства, посещение питомника, транспортировка, одновременное инфицирование ретровирусами (Poland et al, 1996; Rohrer etal, 1993)), профилактика стресса является важным элементом контроля заболевания.
В питомниках инфицирование котят FCoV происходит еще до отъёма, кормящая кошка чаще всего является источником инфекции, это показательно для находящихся в изоляции пометов. Возраст инфицирования варьирует: может наблюдаться в 5-6 недель сразу после потери клострального иммунитета, а в некоторых случаях уже и к 2 недельному возрасту (Lutz et al 2002).
Фекалии содержат FCoV в высоких концентрациях, поэтому фекально-оральный путь передачи является наиболее важным, при этом лотки для экскрементов представляют собой основной источник инфекции в группах. Слюна также может играть роль в группах при тесном контакте или у животных, меняющихся кормушками (Addie&Jarrett, 2001). Трансплацентарное заражение описано, но это происходит крайне редко и от матерей, у которых заболевание развилось во время беременности (Pastoret& Henroteaux, 1978, Addie&Jarrett,1990). Передача FCoV от кошек больных FIP возможна, но важно отметить, что это почти никогда не приводит к болезни. Действительно, в естественной среде FIP не является контагиозным, но может передаваться экспериментально. После естественного инфицирования кошки выделяют FCoV с фекалиями от одной недели (Pedersen etal, 2004) и более. Некоторые кошки, становясь переносчиками, выделяют вирус в течение всей жизни (Addie&Jarrett, 2001) и в высоких количествах (Horzinek & Lutz, 2000). Пока кошки остаются инфицированными, выделение FCoV в фекалиях остается постоянным (Addie&Jarrett, 2001).
Патогенез
У большинства кошек, инфицированных FCoV, развивается асимптоматичная инфекция или слабо выраженный энтерит. Только у части этих кошек развивается инфекционный перитонит кошек и (или) полигранулёматозный полисерозит (Pedersen etal, 1981; Pedersen, 1987). При репликации вируса в моноцитах и макрофагах возникает мутация (Poland et al, 1996; Vennema et al, 1998; Cornelissen et al, 2007 Haijema et al, 2004; Rottier et al, 2005). В поддержку этой гипотезы говорит наличие высоковирулентных штаммов FCoV, которые способны индуцировать инфекционный перитонит кошек, хотя и в экспериментальных условиях (Poland and Venemma1996) любой FCoV может вызывать FIP. Однако, высокая вирусная нагрузка с высокой вероятностью мутации неструктурных белков (3с) и иммунный ответ кошки определяют, разовьется или нет FIP (Addie et al, 1995, Dewerchin et al, 2005; Dye&Siddell,2007; Meli et al, 2004, Rottier et al, 2005; Kipar et al, 2006).
Согласно другой теории, два патологических типа FCoV независимо циркулируют в природе. Эта теорию поддерживает Brownetal (2009), но она не объясняет спорадическую, неэпидемическую встречаемость FIP.
FIP встречается в 2 проявлениях:
1. выпотная, «влажная» форма, которая характеризуется полисерозитами (например, выпот в перикард и (или) в грудную и брюшную полость) с проявлением васкулита, как следствие повреждения стенки кровеносных сосудов и экстравазации макрофагов (Kipar et al, 2005)
2. не выпотная, «сухая» форма, характеризующаяся гранулематозными поражениями органов.
Эти две формы отражают клинические крайности, большинство кошек имеют симптомы и поражения, характерные для обеих форм. У молодых кошек описана редкая узловая кишечная форма с диареей и рвотой, в ассоциации с пиогранулематозными поражениями (Van Kruiningen et al, 1983; Harvey et al, 1996). Все формы инфекционного перитонита кошек смертельны.
Прогрессирование заболевания может быть следствием выраженной иммунодепрессии вследствие истощения Т-клеток (de Groot-Mijnesetal, 2005). Иммунный ответ, обусловленный Т-клетками, вероятно, является единственным эффективным ответом, направленным против прогрессирования заболевания (Pedersen, 1987; Cornelissen etal, 2007).
Попытки определить распределение FCoV в тканях, имеющих диагностическую ценность при FIP, встретили трудности. У больных кошек вирус реплицируется в высоких титрах в моноцитах и может быть найден во многих органах (Kipar etal, 2005).У здоровых кошек инфицированных FCoV, вирус, главным образом, находится в кишечнике. Однако, при использовании RT-PCR может быть выявлен низкий уровень виремии, ассоциированной с моноцитами (Gunn-Mooreetal,1998b; Herrewegh et al, 1995; Meli et al, 2004). Высокий уровень репликации был продемонстрирован в органах асимптоматичных кошек, в течение первых месяцев после экспериментального инфицирования FCoV типа I (Meli et al, 2004).
Значительная разница в репликации вируса в гемолимфатических тканях наблюдается между кошками, которые умерли от инфекционного перитонита, и здоровыми, длительное время инфицированных (Kipar et al, 2006). Моноциты и макрофаги остаются инфицированными даже в присутствие высокого уровня антител. Механизм этого иммунного отклонения может представлять собой отсутствие антителозависимого лизиса вследствие отсутствия вирусных антигенов на поверхности инфицированных клеток (Dewerchin et al, 2006; Cornelissen et al, 2007). Прямым следствием становится состояние «дремлющей инфекции» и длительный инкубационный период. Активация моноцитов и периваскулярных макрофагов может вести к развитию типичных пиогранулематозных и васкулит/периваскулярных поражений в различных тканях и органах, включая легкие, печень, селезенку, сальник и головной мозг животных (Kipar et al, 2005; Berget al, 2005).
Диагноз
Прижизненная диагностика инфекционного перитонита остается сложной задачей. Иногда окончательный диагноз может быть невозможен вследствие инвазивности биопсии органов, а достоверные неинвазивные подтверждающие методики у кошек с отсутствием выпота на данный момент не разработаны. Выпоты нужно искать в первую очередь. У кошек без выпотов должны быть оценены различные данные — анамнез, клинические симптомы, лабораторные изменения, титр антител (Rohreretal, 1993), и они должны использоваться для принятия решения о дальнейших диагностических процедурах.
Гематология
Гематологические изменения всегда наблюдаются у кошек с инфекционным перитонитом, но эти изменения не патогномоничны. Количество лейкоцитов может быть снижено или увеличено. Лимфопения наблюдается часто, однако, лимфопения в комбинации с нейтрофилией встречается и как типичная «стрессовая лейкограмма», которая может сопровождать многие другие заболевания. Нормальное количество лимфоцитов делает инфекционный перитонит кошек менее вероятным. Слабая или умеренная нерегенеративная анемия может сопровождать FIP, но она неспецифична и также может встречаться при многих хронических заболеваниях кошек.
Частой лабораторной находкой является увеличение общей концентрации белка в сыворотке крови, вызванное повышением фракции глобулинов, главным образом γ-глобулинов (Paltrinieri et al, 2001, 2002). Гиперглобулинемия была найдена примерно у 50% кошек с выпотом и 70% кошек без выпота (Sparkes et al,1994). После экспериментального инфицирования вначале наблюдается увеличение α2- глобулинов, в то время как γ-глобулины и титры антител увеличиваются незадолго до появления клинических симптомов (Pedersen 1995; Gunn-Moore et al, 1998). Общий белок в сыворотке крови может достигать очень высоких концентраций — 120 г/л и даже выше.
Отношение альбумина к глобулину имеет значительно более высокую диагностическую ценность, чем просто общее содержание протеина или только концентрация γ-глобулина. Как правило, происходит снижение сывороточного альбумина вследствие сниженного синтеза (Shelly et al, 1988; Rohrer et al, 1993; Hartmann et al, 2003). Низкие уровни альбумина также ассоциируются с потерей протеина, вызванной, например, гломерулопатией вторичной к отложению иммунных комплексов, или экстравазацией богатой протеинами жидкости при васкулите (Hartmann et al, 2003). Пороговое значение (максимальная эффективность) отношения альбумина к глобулину был определен как 0,8 (Hartmann et al, 2003; EBM класс I).
Электрофорез белков сыворотки крови может показывать гипергаммаглобулинемию, как поликлональную, так и моноклональную, а также увеличение белков острой фазы.
Другие лабораторные параметры (печеночные ферменты, билирубин, мочевина, креатинин) могут быть вариабельно увеличены, в зависимости от степени и локализации повреждения органов, но обычно не имеют пользы для постановки диагноза. Метаболизм билирубина и его экскреция в билиарную систему нарушается вследствие высоких уровней TNF-α (тканевого фактора некроза), который ингибирует трансмембранный транспорт. Гипербилирубинемия и желтуха помимо нарушения транспорта, зачастую отражают и степень некроза печени и (или) гемолиза (Hartmannetal, 2003). Иногда, билирубин увеличивается как следствия заболевания желчных протоков или холестаза и обычно наблюдается у септичных животных. Таким образом, высокий билирубин в отсутствие гемолиза и подъёма активности печеночных ферментов должен увеличивать подозрение на инфекционный перитонит кошек.
Диагностическая ценность уровней белков острой фазы низкая. На примере α1-кислого гликопротеина (AGP), который повышается у животных с инфекционным перитонитом кошек (Duthieetal,1997; Paltrinieri, 2008). Высокие уровни AGP в сыворотке крови (>3 мг/мл) сопровождают инфекционный перитонит кошек (Paltrinieri et al, 2007a), как, впрочем, и другие воспалительные процессы. Повышение AGP может быть и у асимптоматичных кошек, инфицированных FCoV, особенно в домашних условиях, где инфекция эндемична (Paltrinieri et a 2007).
Исследование выпотной жидкости
Если имеется выпот, наиболее важным диагностическим шагом является сбор жидкости, поскольку тесты по исследованию выпота имеют более высокую диагностическую ценность, чем те, которые выполняются с кровью. Однако, только около половины кошек с выпотами страдают от инфекционного перитонита (Hirschberger et al, 1995). Хотя прозрачный, желтый («цвета янтаря») выпот вязкой консистенции часто называется типичным, этого не достаточно для диагностики заболевания. Жидкость может иметь и нетипичный вид, есть сообщения даже о хилезных выпотах (Savary et al, 2001). Обычно содержание протеина высокое (>35 г/л), что характерно для экссудата, в то время как содержание клеток низкое ( 0.8, прогноз негативный (Shelly et al,1988). Дифференциальный диагноз включает воспалительное заболевание печени, лимфому, сердечную недостаточность, тромбоз магистральных вен, бактериальный перитонит или плеврит.
Тест Ривальта является простым, недорогим методом, который не требует специального лабораторного оборудования. Он был введен в практику итальянским исследователем Ривальтом в 1900 г для дифференциации между транссудатами и экссудатами в гуманитарной медицине. Он также используется и у кошек для дифференциации между выпотами вследствие инфекционного перитонита кошек и выпотами, вызванными другими заболеваниями (Hartmann et al,2003; EBM класс I). К положительной реакции ведут не только высокое содержание протеина, но и высокие концентрации фибриногена и воспалительных медиаторов.
Приложение. Тест Ривальта
Прозрачная пробирка объёмом 10 мл наполняется примерно 7-8 мл дистиллированной воды, в которую добавляется 1 капля уксусной кислоты (98%) и тщательно смешивается. На поверхность этого раствора осторожно наслаивается 1 капля выпотной жидкости. Если капля растворяется и исчезает и раствор остается прозрачным, тест Ривальта считается отрицательным. Если капля сохраняет свою форму, остается прикрепленной к поверхности или медленно опускается вниз (напоминая медузу), тест Ривальта считается положительным.
В исследовании кошек с выпотами (частота встречаемости инфекционного перитонита кошек 51%) тест Ривальта имел положительную диагностическую ценность в 86% случаев и негативную в 96%, для инфекционного перитонита кошек. Положительные результаты теста Ривальта могут быть также получены и у кошек с бактериальными перитонитами или лимфомой, но эти выпоты обычно легко дифференцировать при помощи макроскопического исследования, цитологии и/или бактериальной культуры.
Спинномозговая жидкость
В анализе спинномозговой жидкости, полученной от кошек с неврологическими симптомами в вследствие инфекционного перитонита кошек, можно обнаружить увеличенное количество белка (50-350 мг/дл; при нормальном уровне Антитела
Титры антител, измеренные в сыворотке крови, интерпретируют с осторожностью, вследствие повсеместного распространения FCoV, высокий процент здоровых кошек имеют положительный титр антител. Некоторые авторы утверждают, что смертность у кошек вследствие ложной интерпретации результатов тестов на антитела к FCoV выше, чем от инфекционного перитонита кошек (Pedersen, 1995).
Не существует «теста на антитела к инфекционному перитониту кошек» и измеряются только антитела против FCoV. Кроме того, методология и, таким образом, результаты сильно различаются между лабораториями. Важно понимать, что наличие антител не доказывает наличие FIP, а их отсутствие не исключает FIP. Приблизительно в 10% случаев у кошек с клиническими проявлениями FIP определяется серонегативность (Hartmann etal, 2003). У кошек с молниеносной формой FIP титры могут снижаться в терминальной стадии (Pedersen, 1995a), вследствие ofin-vivo imи иммунной абсорбции, антитела связываются с большим количеством вирусных антигенов в организме и оказываются недоступными для тестирования. Очень высокие титры могут иметь определенную диагностическую ценность, в плане увеличенной вероятности инфекционного перитонита кошек (Hartmann et al, 2003).
Измерение антител в жидкостях, кроме крови не рекомендовано (Boettcher et al, 2007; Foley et al, 1998).
FCoV ПЦР с обратной транскриптазой (RT-PCR) крови иногда используется как диагностический метод, но он не дифференцирует мутированный, взывающий FIP, и обычный, не мутированный FCoV (Fehr et al, 1996). Положительный FCoV RT-PCR получали не только у кошек с FIP, но и у здоровых переносчиков, у которых не развивался инфекционный перитонит в течение 70 месяцев (Gunn-Mooreetal, 1998b; Meli etal, 2004; Gamble et al, 1997; Herrewegh et al,1997; EBM класс I). Негативный FCoV RT-PCR также часто обнаруживается у кошек с FIP (Hartmann et al, 2003). Более достоверным подходом является измерение информационных РНК методом RT-PCR в крови, их уровни коррелируют с уровнем репликации FcoV с вероятностью мутации. Однако, справедливость этого предположения не доказана, поскольку от 5 до 50% здоровых кошек были PCR- позитивны (Simons et al, 2005; Can-Sahnak et al, 2007), к тому же тест недоступен в Европе.
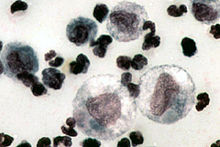
Иммуноокрашивание FCoV антигена в макрофагах
Методы выявления FCoV включают поиск антигена в макрофагах при использовании иммунофлуоресценции (в макрофагах выпота) или иммуногистохимии (в тканевых макрофагах образцов биопсии). В то время как FCoV может присутствовать системно у здоровых кошек, только в случае инфекционного перитонита кошек будет иметься достаточное количество антигена в макрофагах. Поэтому иммунофлуоресценция внутриклеточного FCoV антигена в макрофагах выпотной жидкости имеет 100% диагностическую ценность для FIP. Низкая негативная прогностическая ценность (57%), установленная в контролируемом исследовании, могла наблюдаться вследствие низкого количества макрофагов в образцах выпота — даже если кошки имели подтвержденный FIP (Hartmann etal, 2003). Иммуногистохимия для выявления FcoV антигена в тканях также дает 100% диагностическую ценность в случае положительного результата (Tammer et l, 1995; Kipar et al 1998b). Однако, для получения образцов ткани обычно необходимы инвазивные методы, такие как лапаротомия или лапароскопия. Когда сравнивались истинная биопсия и тонкоигольная аспирация ткани печени и почек при некропсии, их диагностическая чувствительность была схожей, но наблюдалась более высокая чувствительность ткани печени, в сравнении с тканью почек (Giordano et al,2005). Значение тонкоигольной аспирации под контролем УЗИ для диагностики инфекционного перитонита кошек in vivo исследуется.
В целом, имеется 2 диагностические стратегии для получения окончательного диагноза на инфекционный перитонит кошек:
1. Иммунофлуоресцентное окрашивание FCoV антигена в макрофагах, если имеется выпот.
2. Иммуногистохимия, если выпот отсутствует, однако должны быть получены образцы тканей из пораженных органов.
Лечение заболевания
Любая кошка в госпитале является потенциальным источником FCoV инфекции, поэтому, должны быть предприняты стандартные гигиенические мероприятия. Кошка с FIP будет выделять FCoV, однако подвергшийся мутации вирус, редко вызывает заболевание, но это не отменяет необходимости соблюдения мер предосторожности, чтобы избежать распространения вируса. При наличии нескольких совместно проживающих кошек, все животные будут инфицированы, поэтому, нет смысла в изоляции кошки, больной FIP. В ситуации, когда кошка с FIP подверглась эвтаназии и дома нет других кошек, рекомендуется подождать в течение 2 месяцев, прежде, чем взять новую кошку.
Лечение или эвтаназия должны рассматриваться только после попыток установить окончательный диагноз. Если установлен диагноз инфекционного перитонита кошек, то прогноз фатальный, медиана выживания после постановки диагноза составляет примерно девять дней. Факторами, которые прогнозируют короткое время выживания, являются низкое количество лимфоцитов, высокий билирубин, наличие большого количества выпота. Кошки, состояние которых не улучшается в течение трех дней, с малой вероятностью ответят на лечение, должна быть рассмотрена эвтаназия. Иногда кошки выживают в течение нескольких месяцев после постановки клинического диагноза, но неясно, связано ли это с лечением. Имеются даже сообщения о «выздоровевших» кошках, но в этих случаях не был получен лабораторный диагноз.
Поскольку инфекционный перитонит кошек вызывается воспалительными и неадекватными иммунными ответами на FCoV, поддерживающее лечение имеет целью их подавление, обычно с помощью кортикостероидов. В настоящее время нет контролируемых исследований, которые доказали бы какой-либо полезный эффект от проводимого лечения. Иногда, в случаях с лечением кортикостероидами, наблюдается улучшения протяженностью до нескольких месяцев, но эти сообщения эпизодичны, не существует надежных контролируемых наблюдений (EBM класс III).
Многочисленные методы лечения были испытаны и данные из одного контролируемого исследования опубликованы. В этом плацебо — контролируемом исследовании участвовало 37 кошек, с применением Ω-интерфероном кошек и не показало положительных результатов в сравнении с плацебо (Ritzetal, 2007; EBM класс I). Используются и другие многочисленные препараты, но не имеется контролируемых исследований, чтобы подтвердить их эффективность.
Противовирусные препараты:
Рибавирин. Работает in vitro, но токсичен для кошек. Не рекомендован (EBM класс II)
Видарабин. Работает in vitro, но токсичен у кошек. Вероятно, неэффективен (EBM класс IV)
Человеческий α-интерферон п/к в высоких дозах. Хотя человеческий α-интерферон оказывает in vitro влияние на FCoV, по данным экспериментальных исследований подкожное введение неэффективно. Неэффективен (EBM класс II)
Человеческий α-интерферон – орально в низких дозах. Исследований не проводилось. Если задается орально, действует только как иммунностимулятор. Необходимо избегать иммунной стимуляции у кошек с FIP
Кошачий Ω-интерферон. См. выше.
Иммуносупрессанты, НПВС и другие:
ГКС Нет контролируемых исследований. Состояние некоторых кошек улучшается во время лечения, срок жизни может составлять несколько месяцев, но не избавляет от FIP. В настоящее время является поддерживающим лечением выбора (EBM класс III) При наличии выпота возможно введение дексаметазона в грудную или брюшную полость.
Пентоксифиллин. Применяется при лечении васкулитов. Некоторые врачи в своей практике применяют его, но опубликованных исследований или сообщений нет. Требуются исследования (EBM класс IV).
Гидрохлорид озагреля (ozagrel). Ингибитор синтеза тромбоксана. Эффект — подавление воспалительного ответа. Использовался только в 2 случаях с положительным эффектом. Необходимы контролируемые исследования (EBM класс III).
Циклофосфамид. Иммуносупрессант. Нет опубликованных исследований. Может быть рассмотрен в комбинации с кортикостероидами. (EBM класс IV).
Хлорамбуцил. Иммуносупрессант. Нет опубликованных исследований. Может быть рассмотрен в комбинации с кортикостероидами. (EBM класс IV).
Азатиоприн. Токсичен для кошек. Иммуносупрессант. Нет опубликованных исследований. Не рекомендуется (EBM класс IV).
Ацетилсалициловая кислота (аспирин) — дозы, ингибирующие тромбоциты. Действие направлено на подавление воспалительного эффекта, в т.ч. против васкулита. Нет опубликованных исследований. Может давать некоторый положительный эффект, но возможны побочные эффекты, если применяется вместе с кортикостероидами в высоких дозах.
Циклоспорин А. Иммуносупрессант. Нет опубликованных исследований. Не рекомендуется, поскольку направлен больше на клеточный иммунитет, нежели чем на гуморальный (EBM класс IV)
Вакцинация
Было сделано много попыток получения вакцины против инфекционного перитонита кошек. Однако большинство этих исследований оказались неудачны. В настоящее время, имеется только одна коммерчески доступная вакцина Primucell©, Pfizer в США и некоторых европейских странах. Primucell® содержит чувствительный к температуре мутантный вирус типа 2 FCoV штамм DF2. Вакцина назначается интраназально и индуцирует иммунный ответ слизистой посредством индукции IgA и клеточно-обусловленного иммунитета. Однако в редких случаях она может вызывать сероконверсию и титры обычно низкие. Результаты экспериментальных исследований защитного эффекта непостоянны, с колеблющимся уровнем защиты от 0 до 75% (Hoskinsetal, 1995; McArdleetal, 1995; Scottetal, 1995; Gerberetal 1990). Результаты исследований в естественных условиях также противоречивы. Не было найдено разницы между вакцинированной группой и группой с плацебо при использовании вакцины в группе персидских племенных кошек (Fehretal 1995). В двойном слепом исследовании, включающем 609 кошек, не было выявлено разницы между вакцинированными кошками и группой плацебо в течение первых 150 дней после вакцинации. Однако после 150 дней наблюдалось меньше случаев инфекционного перитонита кошек в вакцинированной группе, в сравнении с группой плацебо (1 против 7).
В другом исследовании была установлена 75% эффективность при тестировании вакцины в большом приюте кошек в США (Postorino Reeves, 1995). В этом исследовании все котята были серонегативны до вакцинации. Следовательно, применение Primucell® нецелесообразно для кошек, которые уже контактировали с естественной FCoV инфекцией, что неудивительно и не является виной вакцины. Поскольку Primucell® лицензирован для использования с 16 недель возраста и не эффективен у более молодых животных (Lutzetal 2002), применение его также нецелесообразно для большинства котят, особенно из питомников или живущих в окружении нескольких кошек, поскольку в большинстве случаев они уже инфицированы и серопозитивны.
Первичная вакцинация
Вакцинация от инфекционного перитонита кошек не рассматривается как основная вакцина и используется только у котят, которые с малой вероятностью контактировали с FCoV, например, при раннем отъеме или если они поступают в эндемичное по FCoV окружение.
Первичная вакцинация состоит из двух доз, производится с интервалом в три недели, начиная с 4-х месячного возраста.
Повторная вакцинация
Для кошек, образ жизни которых требует первичную вакцинацию, могут быть рассмотрены повторные вакцинации. Хотя проведенных исследований по продолжительности иммунитета недостаточно, предполагается, что он краткосрочный и повторные вакцинации могут потребоваться. Эффект повторных вакцинаций в FCoV- контаминированном окружении не изучен.
Контроль в специфических ситуациях
Инфекционный перитонит является проблемой для кошек, живущих группами, особенно в племенных питомниках и приютах для животных. Поскольку наиболее важным путем передачи является фекально-оральный, гигиена является основным направлением контроля FIP в любой среде обитания. FcoV инфекция поддерживается непрерывными циклами инфицирования и реинфицирования (Foleyetal, 1997, Addieetal, 2003), причем зачастую источник инфекции находится в туалете. Инфекционный перитонит кошек редко является проблемой для кошек, ведущих естественный образ жизни со свободным выходом на улицу. Цель профилактики в любом жилище должно быть снижение контакта кошек с FCoV инфекцией. Это может быть достигнуто совместным проживанием не более трех хорошо адаптированных животных, соблюдение строгой гигиены и обеспечение выхода на улицу, чтобы дать возможность кошкам зарывать фекалии. Если последнее невозможно, должно быть обеспечено достаточное количество туалетных лотков, на один больше, чем количество кошек, частая их очистка и размещение в разных комнатах пищи и воды и туалетов.
Племенные питомники
Племенные питомники находятся в условиях повышенного риска развития FIP. В некоторых питомниках делались попытки контролировать распределение вируса путем сегрегации. Была предложена тактика разделения кошек, выделяющих большие количества FCoV, с кошками с низким уровнем выделения вируса и кошками, не выделявшими вирус. Ценность этого подхода неоднозначна. Кошки с высоким уровнем выделения вируса могут быть выявлены с использованием скринингового RT-PCR фекалий, но при этом необходимы повторные исследования кала, что представляет практические трудности.
У котят инфекционный перитонит кошек обычно развивается после отъема (Caveetal, 2002). Заводчики часто не знают о наличии FCoV инфекции, поскольку заболевание и смерть от FIP обычно наблюдается после попадания котенка в новое окружение. Большинство котят защищены материнскими антителами до 5-6 недельного возраста. Можно профилактировать FCoV инфекцию путем изоляции беременных самок за 2 недели до родов с последующим отъемом котят и их изоляцией до 5-6 недельного возраста, для того, чтобы очистить окружающую среду до передачи новым владельцам (Addie&Jarrett, 1990, 1992 and 1995). Для того чтобы эта тактика сработала, заводчик должен обеспечить гигиену на хирургическом, или даже на микробиологическом уровне, чему он не обучен. Кроме того, существует противоречивая информация об эффективность этого метода, по данным некоторых источников он не работает. Трансплацентарная передача FCoV не является значимой (Addie&Toth, 1993).
Другие питомники и приюты
Должны быть предприняты строгие гигиенические меры предосторожности, чтобы попытаться минимизировать распространение вируса. В идеале, кошки должны находиться отдельно друг от друга. Дизайн новых питомников должен рассматривать контроль инфекционных заболеваний и снижение стресса как первоочередную задачу. Может быть рассмотрена вакцинация кошек, которые имеют малую вероятность контакта с FCoV при поступлении в питомник.
В редакции ветврача ВЛДЦ «ДиаВЕТ» Секач В.В.
Источник