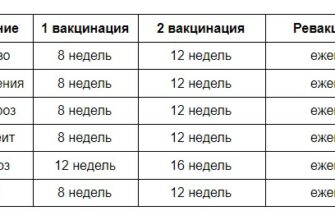
Новый подход к лечению калицивироза и инфекционного ринотрахеита у кошек
Автор: Ильченко Е. И., Ильченко А. А., Московская обл., г. Сергиев Посад, Ветконсультация; Ожерелков С. В., г. Москва, Институт полиомиелита и вирусных энцефалитов им. М. П. Чумакова
Опубликовано: 4 сентября 2008

Почти 90% всех респираторных инфекций у кошек вызывают вирусы, относящиеся к двум семействам: ДНК-содержащих герпесвирусов и РНК-содержащих калицивирусов. Герпесвирусы вызывают инфекционный ринотрахеит (ИРТ), а калицивирусы — калицивироз. Из кишечных вирусных инфекций наиболее часто выявляется панлейкопения.
Диагноз ставили на основании клинических признаков. Для ИРТ это сухой кашель, слизистые или гнойные выделения из носа, конъюнктивит, вялость, потеря аппетита, часто повышенная температура. При калицивирозе к перечисленным симптомам добавляются язвенные поражения в полости рта и обильное слюнотечение. При панлейкопении наиболее распространенными симптомами являются рвота, понос, сильная болезненность живота, сначала повышение температуры до 40,5 ºС, а затем снижение до 36 – 35 ºС с быстро нарастающей дегидратацией.
Учитывая большую распространенность этих инфекций, мы столкнулись с проблемой выбора оптимальной схемы терапии.
Это конечно симптоматическая терапия. При респираторных инфекциях — антибиотики группы пенициллина — амоксициллин (кламоксил), ампициллин (альбипен) и пенициллин (бициллин 3 и неопен). Отхаркивающие средства, санация полости рта при калицивирозе, введение растворов глюкозы, витаминов и микроэлементов истощенным животным. При панлейкопении — антибиотики, к которым чувствительна грамотрицательная микрофлора кишечника — гентамицин, неопен (неомицин). Введение солевых растворов: 0,9% NaCl, р-р Рингера, р-р 5%-ной глюкозы. Мы также в обязательном порядке используем атропин, дроперидол, но-шпу, сульфокамфокаин, в тяжелых случаях — преднизолон.
Основным для лечения вирусных заболеваний, особенно респираторных, является этиотропная терапия. Мы испробовали много препаратов — камедон, анандин, витафел, кинорон, фоспренил, но в итоге остановились на максидине. Максидин апробирован более чем на 50 кошках: 23 с ИРТ, 19 с калицивирозом и 12 с панлейкопенией. Использовали следующую схему лечения: по 0,5 мл 2 раза в день, подкожно в течение 5 дней. Поскольку препарат болезненный, котятам его вводили с 0.5% новокаином. Возраст животных колебался от 1 месяца до 14 лет. С диагнозом ИРТ все животные выздоровели. Обычно улучшение наступало на 3-й день после начала лечения. Лишь у 3 животных болезнь приобрела хроническое течение, и они выздоровели на 12 – 14-й день.
При калицивирозе улучшение также наступало на 2 – 3-й день, кошки быстро выздоравливали, лишь одна пала — в результате длительного голодания и сильной дегидратации наступили необратимые изменения в организме. С панлейкопенией картина несколько иная. Из 12 пациентов пали 4, что составляет 33%. Причем некоторых из них лечить начали с самого начала заболевания. Причину столь высокой смертности мы обсудим ниже. Почему же мы выбрали максидин в качестве основного средства этиотропной терапии при вирусных заболеваниях кошек?
Максидин это новый металлоорганический иммуностимулятор, разработанный фирмой «Микро-плюс». В экспериментах на базе кафедры ветеринарной вирусологии Ветакадемии им. К. И. Скрябина было показано, что максидин обладает выраженным противовирусным эффектом в отношении вируса герпеса 1-го типа — возбудителя ИРТ (данный эффект был показан на чувствительной к вирусу линии клеток Таурус-1; при добавлении препарата, титры вируса снижались более чем в 100 раз по сравнению с контролем). Кроме того, в опытах на мышах была показана выраженная протективная активность максидина при экспериментальном клещевом энцефалите (при однократном введении препарата одновременно с летальной дозой вируса более 50% животных выживало, тогда как в контрольной, не обработанной препаратом группе, летальность составила 100%. Также в опытах на мышах было показано, что максидин является индуктором общего сывороточного интерферона (ИФН): высокие титры ИФН обнаруживали в сыворотке крови через 5, 24, 48, 72 часа после введения препарата.

В настоящее время механизмы иммуномодулирующего действия максидина находятся в стадии изучения, поэтому схема его применения как иммуномодулятора уточняется.
Вывод: максидин может быть рекомендован для включения в схему комплексной терапии при калицивирозе и ИРТ у кошек в качестве основного средства этиотропной терапии.
Материалы конференции г. Ставрополь, 1999 г .
Источник
Эффективность препарата Ципровет таблетки при бактериальных инфекциях собак и кошек
Польшкова Екатерина Владимировна, кандидат ветеринарных наук, главный ветеринаный врач клиники «МиВ», г.Москва
Енгашев Сергей Владимирович, доктор ветеринарных наук, профессор, генеральный директор ООО «Научно-внедренческий центр Агроветзащита»
Испытан антибактериальный препарат Ципровет таблетки на собаках и кошках при лечении бактериальных инфекций. Клиническое выздоровление наступало на 3 — 4 сутки. Эффективность лечения высокая. Ключевые слова: собаки, кошки, бактериальные инфекции, лекарственное средство Ципровет.
Efficacy Ciprovet pills to bacterial infections of dogs and cats
Tested antibacterial Ciprovet pills on dogs and cats in the treatment of bacterial infections. Clinical recovery occurred in 3 — 4 day. Efficacy of treatment is high. Key words: dogs, cats, bacterial infections, drug Ciprovet.
В последние годы ХХ столетия группы фторхинолонов заняли одно из ведущих мест среди антимикробных химиотерапевтических средств.
Фторхинолоны относятся к антимикробным препаратам с бактерицидным действием, при этом характеризуются высокой бактерицидной активностью. Бактерицидный эффект проявляется на уровне минимальных подавляющих концентраций (МПК) или при концентрациях, превышающих МПК в 2 — 4 раза, реже – в более высоких концентрациях.
Высокая активность фторхинолонов в отношении грамотрицательных и грамположительных аэробных бактерий подтверждена в многочисленных экспериментах in vitro на различных по патогенезу моделях в опытах на мышах, крысах, кроликах, морских свинках, при высоких инфицирующих дозах, пероральном и парентеральном введении препаратов, в условиях раннего и отсроченного лечения.
Ципрофлоксацин хорошо всасывается при приеме внутрь. Препарат не обладает способностью к биокумуляции, и как правило, хорошо переносится животными.
Фирмой ООО «НВЦ Агроветзащита» разработана серия препаратов с действующим веществом ципрофлоксацин.
Нами изучены терапевтические свойства препарата Ципровет таблетки на собаках и кошках, поступивших в клинику и больных бактериальными инфекциями в течение 2009 года.
Материалы и методы исследования
Было проведено 2 опыта. Под опытом №1 находилось 8 собак, 9 кошек и 4 декоративных крысы с различными бактериальными и инфекциооными заболеваниями.
Препарат Ципровет таблетки применялся как антибактериальное средство широкого спектра действия в терапии при лечении:
— инфекционного трахеобронхита собак – 4 животных;
-инфекции верхних дыхательных путей у кошек, в том числе инфекционном ринотрахеите, калицивирозе – у 5 животных;
— инфекции мочевыводящих путей у кошек и собак – 8 животных;
— в комплексной терапии при лечении респираторного микоплазмоза, инфекционного ринита и бронхопневмонии у декоративных крыс – 4 животных.
Диагноз ставился комплексно, на основании анамнеза, клинико-лабораторных показателей, рентгенологического и вирусо-бактериологического исследования.
Опыт №2 проведен на 24 собаках различных пород и возрастов. В опытную группу отбирались животные с клиническими признаками бактериальных инфекций: мочевыводящих путей (3 животных), верхних дыхательных путей (5 животных), желудочно-кишечного тракта (10 животных). Контрольная группа состояла из 6-ти собак.
Всех подопытных животных лечили препаратом Ципровет таблетки, препарат применялся с учетом массы животного (1 таблетка на 3 кг массы веса) принудительно, закладывая на корень языка или в измельченном виде в смеси с кормом одни раз в сутки в течение 3-7 дней.
Контрольных животных подвергали лечению препаратом Энроксил таблетки (производства КРКА, Словения) в дозе 1 таблетка/3 кг массы животного перорально, 1 раз в сутки в течение 5-10 дней на фоне симптоматической терапии.
Наблюдение за клиническим состоянием животных вели на протяжении 15 суток от начала опыта. Через 1, 5 и 10 суток лечения подопытных животных Ципроветом проводили клиническое исследование крови (определяли количество эритроцитов, лейкоцитов, гемоглобина) и биохимических показателей (общий белок, белковые фракции, аспартатаминотрансферазу и аланинаминотрансферазу).
За подопытными животными следили в течение всего периода исследований. Ни у одного не отмечено признаков местно-раздражающих реакций, аллергической реакции на введение Ципровета, нарушение нормальной, кишечной микрофлоры (жидкий стул) отмечено у одной кошки с ринотрахеитом и 3 крыс с респираторным микоплазмозом. При динамическом наблюдении за животными отмечали улучшение клинической симптоматики, нормализацию температуры тела при гиперемии, снижение СОЭ и лейкоцитоза, начиная с 3 дня лечения, нормализацию АсАт и АлАт.
Введение препарата не вызывало клинических изменений, животные адекватно реагировали на внешние раздражители.
Сроки наступления клинического выздоровления в опытной и контрольной группах очень сильно зависели от стадии заболевания. Так, в начальной стадии (1-3 сутки) препараты оказывают стойкий, положительный эффект и болезнь клинически заканчивалась через 3-4 (опытная группа) и 5-6 (контрольная группа) суток. На более поздних стадиях заболевания лечение продолжалось до 5-7 дня в опытной группе и до 8-10 в контрольная группе. Летальных исходов не было.
Аллергических реакций и побочного действия при введении Ципровета таблеток и Энроксила таблеток не отмечалось.
Следует отметить, что у подопытных собак и кошек на фоне заболевания перед началом лечения отмечали лейкоцитоз, эозинофилию, эритропению, из биохимических показателей – увеличение щелочной фосфатазы, АсАт и снижение АлАт. При исследовании крови на 5 сутки, гематологические и биохимические показатели приближались к физиологической норме, а на 10 сутки нормализовались (таблица 1).
Гематологические и биохимические показатели крови подопытных собак и кошек на фоне введения Ципровета таблеток
Источник
Значимость применения ципрофлоксацина в клинической практике
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
В настоящее время фторхинолоны (ФХ) оправданно остаются одними из самых популярных антибактериальных препаратов. Это обусловлено тем, что ФХ обладают широким спектром действия, хорошими фармакокинетическими характеристиками, низкой токсичностью, и что особенно важно – они активны в отношении микроорганизмов с приобретенной резистентностью ко многим антибактериальным препаратам. В отечественной и зарубежной литературе представлено достаточно много доказательств – это результатам мультицентровых исследований, клинические наблюдения и экспериментальные работы, посвященные эффективности и безопасности ФХ.
Одним из ярких и хорошо изученных ФХ является ципрофлоксацин. Все ФХ обладают бактерицидным эффектом, который проявляется при минимальных подавляющих концентрациях (МПК) или МПК превышающих не более чем в 2–4 раза. Так, было показано, что для ципрофлоксацина МПК составляет 0,016–2 мг/л в отношении P. Aeruginosa, однако имеются штаммы псевдомонад, устойчивые к ципрофлоксацину – МПК от 8 до 32 мг/л, но ципрофлоксацин все равно сохраняет преимущества; также следует отметить его активность в отношении легионелл, Enterobacteriaceae, Y. Pestis. В отношении грамположительных кокков ципрофлоксацин, как и офлоксацин, демонстрирует активность [5].
ФХ проникают в бактериальную клетку через внешнюю мембрану: гидрофильные препараты проникают через пориновые каналы, через которые, кроме ФХ, проникают также и b–лактамные АБ, тетрациклины, хлорамфеникол, аминогликозиды. Гидрофобные ФХ проникают через полисахаридный слой. Таким образом, нарушение проницаемости, например, пориновых каналов не затронет проницаемость через липополисахаридный слой. Процесс выведения ФХ из клетки осуществляется специальными белками–переносчиками [2].
ФХ являются ингибиторами ДНК–гиразы. Блокирование этого фермента приводит к нарушению деления, бактериостазу и быстрой гибели клеток. ДНК–гираза относится к классу топоизомераз II типа. Топоизомеразы содержатся как в клетках прокариотов (бактерий), так и эукариотов (млекопитающих), однако этот фермент у про– и эукариот различается по структуре и функциям; так, ДНК–гираза является основным ферментом, отвечающим за подготовку к репликации ДНК в хромосоме бактерий. Эти функции ДНК–гиразы свойственны только бактериям, у млекопитающихся подобный фермент – топоизомераза II не катализирует укладку ДНК и отличается низкой чувствительностью к ФХ, чем и объясняется отсутствие токсических эффектов, связанных с нарушением биосинтеза ДНК. Однако в бактериальной клетке имеется еще одна мишень для ФХ – топоизомераза IV. Оба фермента (и ДНК–гираза, и топоизомераза IV) необходимы для синтеза бактериальной ДНК, причем было показано, что в грамотрицательных бактериях первичной мишенью является ДНК–гираза, а в грамположительных бактериях топоизомераза более чувствительна к фторхинолонам [5,11]. Таким образом, высокие внутриклеточные концентрации и ингибирование ферментов–мишеней определяют высокую бактерицидную активность препарата.
Антимикробная активность. Ципрофлоксацин относится к числу наиболее активных по действию на грамотрицательные аэробные бактерии (Campylobacter jejuni, Citrobacter diversus, Citrobacter freundii, Enterobacter cloacae, Escherichia coli, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumonia, Moraxella catarrhalis, Morganella morganii, Neisseria gonorrhoeae, Proteus mirabilis, Proteus vulgaris, Providencia rettgeri, Pceudomonas aeruginosa, Salmonella и др.), грамположительные азробы (Bacillus anthracis, Enterococcus faecali (большинство штаммов относительно чувствительны), Lysteria monocitogenes, Staphylococcus aureus, Staphylococcus epiudermidis, Staphylococcus saprophyticus, Staphylococcus pneumoniae, Staphylococcus pyogens), анэробные грамположительные: Staphylococcus haemophilus, Staphylococcus hominis, анэробные грамотрицательные (Acinetobacter Iwoffi, Aeromonas caviae, Aeromonas hydrophilia, Brucella melitensis, Campylobacter coli, Edwadsiella tarda, Haemophilus ducreyi, Klebsiella oxytoca, Legionella pneumophila, Neisseria meningitides и др).
Ципрофлоксацин обладает бактерицидным действием не только на размножающиеся, но и на покоящиеся клетки, для которых характерен наиболее длительный постантибиотический эффект. Ципрофлоксацин демонстрирует активность против организмов, резистентных к пенициллинам, цефалоспоринам и аминогликозидам, а также против гемофильной палочки, пенициллин–продуцицирующим N. Gonorrhoa, Campilobacter sp., и псевдомонады. Грамположительные микроорганизмы, стрептококки и пневмококки слабо ингибируются и демонстрируют резистентность, ципрофлоксацин не применяют в случаях метициллин–резистентных стафиликокковых инфекций [11]. Следует сказать, что природа резистентности к метициллину выяснена не окончательно. Наиболее вероятной и наиболее доказанной причиной являются изменения, возникающие в специфических пенициллинсвязывающих белках клеточной стенки стафилококков. Сейчас в арсенале имеются новые фторхинолоны, активные в отношении грамположительных кокков – моксифлоксацин, гатифлоксацин, клинафлоксацин. Эти ФХ демонстрируют активность против устойчивых к ципрофлоксацину грамположительных бактерий, гораздо большую, чем у ванкомицина и цефтазидима.
Фармакокинетика. Ифиципро®ОД – ципрофлоксацин пролонгированного действия – обеспечивает длительное и равномерное высвобождение ципрофлоксацина. Однократный прием Ифиципро®ОД 0,5 г или 1,0 г обеспечивает концентрацию ципрофлоксацина, эквивалентную двукратному приему обычного ципрофлоксацина 250 мг или 500 мг соответственно. После приема внутрь ципрофлоксацин быстро абсорбируется из желудочно–кишечного тракта. Таблетки Ифиципро®ОД 0,5 г или Ифиципро®ОД 1,0 г показали сравнимые показатели скорости и продолжительности абсорбции в сравнении с немедленной абсорбцией таблеток ципрофлоксацин 250 мг и 500 мг при тех же условиях исследования. Для ципрофлоксацина – Ифиципро®ОД 0,5 г и Ифиципро®ОД 1,0 г после приема однократной дозы пиковые концентрации препарата в плазме достигаются в течение 6–7 часов и составляют 0,784 мкг/мл и 1,393 мкг/мл соответственно. Соответствующие значения площади под фармакокинетической кривой (AUC0–t) – 10,503 и 17,651 мкг/ч/мл. Связывание с белками плазмы крови от 20 до 40%. Ципрофлоксацин хорошо проникает в ткани и жидкие среды организма (легкие, кожные покровы, жировую ткань, мышцы, хрящевую и костную ткань, простату). В активной форме ципрофлоксацин обнаруживается в слюне, секрете слизистой оболочки носовой полости и бронхов, сперме, лимфе, перитонеальной жидкости и секрете простаты. Ципрофлоксацин частично метаболизируется в печени. Около 50% от принятой внутрь дозы экскретируется с мочой в неизмененном виде и около 15% – в виде активного метаболита оксоципрофлоксацина. Почечный клиренс для ципрофлоксацина почти в 2 раза превышает клубочковую фильтрацию, т.к. препарат активно выводится белками–транспортерами. Оставшаяся часть поступившей дозы выводится внепочечным путем– с желчью и через кишечник. Период полувыведения – 3,5–4,5 часа, но он может удлиняться при выраженной почечной недостаточности и у пожилых людей. Ципрофлоксацин является ингибитором для CYP1A2 и CYP3A4. Совместное использование субстратов этих изоферментов и их ингибиторов ведет к угнетению метаболизма субстратов, и как следствие – к развитию побочных эффектов. Так, например, субстратом CYP1A2 является теофиллин [2]. Ципрофлоксацин оказывал менее выраженное влияние на фармакокинетику теофиллина. Однако имеются сообщения, что однократный прием 500 мг ципрофлоксацина не влиял на фармакокинетические параметры теофиллина в стационарной стадии у здоровых людей, 5–дневный прием ципрофлоксацина в низких дозах (по 200 мг 3 раза в сутки) лишь несколько повышал сывороточные концентрации теофиллина у здоровых людей, низкие дозы ципрофлоксацина (11 доз по 250 мг 2 раза в сутки) не влияли на стационарные концентрации теофиллина в крови больных хроническими обструктивными болезнями легких [9].
Резистентность. Развитие резистентности связано с:
1) изменением структуры ферментов–мишеней: ДНК–гиразы и топоизомеразы IV;
2) нарушением транспортных систем – нарушение проникновения в клетку (нарушение приникновения через пориновые каналы) и активное выведение из клетки, а также повышение экспрессии транспортных белков.
Подобные изменения кодируются соответствующими генами. Резистентность носит перекрестный характер только в пределах группы хинолонов и не затрагивает другие АБ препараты.
Токсичность. При использовании ФХ под действием солнечных лучей или УФ–излучения возможны фототоксические реакции. Фотодеградация молекул хинолона под влиянием УФ лучей ведет к образованию свободных радикалов и повреждению кожи.
Также в экспериментах отмечено, что ФХ являются ингибиторами рецепторов g–аминомасляной кислоты, ингибирование усиливается при совместном использовании с НПВП. Это необходимо учитывать у пациентов со склонностью к судорожным припадкам. У экпериментальных животных при щелочной реакции мочи в высоких дозах ФХ могут вызвать образование кристаллов. В клинической практике кристаллоурия отмечается крайне редко. Также было выявлено угнетение гемопоэза, которое было кратким и обратимым. Однако клинические наблюдения свидетельствуют о безопасности использования ФХ у больных с нарушениями в системе гемопоэза. ФХ – малотоксичные препараты. В экспериментальных работах выявлено угнетающее действие ФХ на рост хрящевых тканей у неполовозрелых животных, т.к. они могут ингибировать биосинтез митохондриальной ДНК хондроцитов. У половозрелых животных угнетение хрящевой ткани не наблюдалось. Поэтому использование хинолонов не рекомендовано до 16–18 лет. Однако применение возможно в исключительных случаях при грамотрицательной флоре, устойчивой к другим АБ препаратам. Использование фторхинолонов актуально у детей с муковисцидозом, при тяжелом течении инфекций, вызванных Enterobacter cloаcae, Klebsiella pneumoniae, Pseudomonas aeruginosa, Serratia marcescens [6].
Клиническое применение. Сегодня использование ФХ является альтернативой высокоактивным антибиотикам широкого спектра действия. Наибольшее значение ципрофлоксацин приобрел при лечении тяжелых генерализованных форм бактериальных инфекций, вызванных преимущественно грамотрицательными бактериями и стафилококками с приобретенной устойчивостью к антимикробным препаратам других групп, в том числе штаммами с множественной лекарственной устойчивостью. Не подвергается сомнениям доказанная клиническая эффективность при лечении внебольничных и госпитальных инфекций практически любой локализации:
– верхних и нижних дыхательных путей,
– мочевыделительной системы,
– кожи и мягких тканей,
– костей и суставов,
– печени и желчевыводящих путей,
– пищевого тракта,
– интраабдоминальной инфекции,
– гинекологической инфекции,
– глазной инфекции,
– инфекции центральной нервной системы,
– инфекций, передаваемых половым путем.
Легочные инфекции. Актуально использование ципрофлоксацина и офлоксацина при нозокомиальных ранних вентиляционных пневмониях, нетяжелых пневмониях в ОИТ, а также при обострении ХОБЛ [1]. Оправдано применение фторхинолонов или макролидов при аллергии к b–лактамным АБ. Используют ципрофлоксацин у пожилых при внебольнчной пневмонии в качестве монотерапии или в сочетании с клиндамицином или метронидазолом или b–лактамными АБ, а также при «поздних» пневмониях у пожилых в сочетании с цефепимом или пиперациллином/тазобактамом [4]. Результаты одного мультицентрового исследования у больных с пневмонией, бронхитом, легочными инфекциями при муковисцедозе продемонстрировали клиническую эффективность в 60–70% случаев, а бактериологическую в 81% [5].
Доказана эффективность ципрофлоксацина у больных с обострением ХОБЛ. Сочетание высокой активности против H. influenzae и M. Catarrhalis вместе с хорошим проникновением в мокроту и слизистую бронхов дают преимущества ципрофлоксацину и офлоксацину перед b–лактамными АБ. ФХ демонстрируют клиническую эффективность в 80–95% случаев при обострении ХОБЛ. Ципрофлоксацин более эффективен и в плане бактериальной эрадикации (в первую очередь гемофильной палочки) [7].
Инфекции мочевых путей. Ципрофлоксацин часто применяют при осложненной и неосложненной инфекции мочевыводящих путей. Наиболее часто встречающаяся инфекция нижних мочевых путей – острый цистит, которым по статистике наиболее часто болеют женщины. Чаще всего это один возбудитель, и, как правило, E. Coli (70–95%), второе место занимает S. Saprophyticus (5–20% случаев), еще более редко встречаются Klebsiella, Proteus, стрептококки, энтерококки. Оправданное применение при нижней инфекции мочевых путей ципрофлоксацина связано с тем, что фторхинолоны являются наиболее активными препаратами в отношении E. Coli, обладающей низкой резистентностью к этому АБ. Так, было показано, что в России устойчивость E. Coli к ципрофлоксацину составляет 2,6% против 33% и 18% к ампициллину и ко–тримоксазолу соответственно. Следует отметить, что нижние инфекции мочевыводящих путей склонны к самоизлечению, при выборе АБ следует также учитывать возникновение побочных эффектов. Длительность использования ципрофлоксацина при этой патологии составляет 3–5 дней, а при наличии факторов риска (сахарный диабет, рецидивы инфекции мочевых путей, возраст старше 65 лет) до 7 дней 0,5–0,1 г/сут. Позиционируемое лечение одной дозой может быть назначено при неосложненной инфекции мочевых путей без сопутствующих факторов риска. В данной ситуации следует отдавать предпочтении АБ с длительным периодом полувыведения, таким как ФХ. При развитии острого пиелонефрита АБ терапию назначают более длительно 10–14 дней, а при неэффективности – до 4–6 недель. При тяжелом течении пиелонефрита, а также уросепсисе без полиорганной недостаточности лечение начинают с в/в введения АБ с дальнейшим переходом на пероральные формы. С этой целью используют ципрофлоксацин 0,4–0,6 г/сут. [5,8].
В качестве профилактики при частых рецидивах инфекциях мочевыводящих путей (более 2 обострений в течение месяца или 3 раза в год) используют низкие дозы ципрофлоксацина 0,1 г/сут., а также нитрофураны и ко–тримоксазол [3].
Широкое применение находят ФХ в гинекологии. Известно, что воспалительные заболевания органов таза вызываются различными микроорганизмами, попадающими восходящим путем из нижних половых путей в верхние половые пути. Основными патогенами являются Chlamydia trachomatis, Mycoplasma spp., Ureaplasma urealyticum, Neisseria gonorrhoeae, Streptococcus spp., Escherichia coli, Haemophilus influenzae и др., а также анаэробы, такие как Prevotella spp. и Peptostreptococcus. Точная этиотропная диагностика очень сложна и занимает немало времени, поэтому во многих случаях лечение проводится эмпирически, в связи чем оно должно охватывать большинство вероятных патогенных микроорганизмов.
Остеомиелит и на сегодняшний день остается заболеванием, с трудом поддающимся лечению. Ципрофлоксацин показывает хорошую эффективность и переносимость (продолжительность приема от нескольких недель до года и более) при данной патологии. Имеются данные о клинической эффективности от 75 до 92% [5].
Инфекции кожи и мягких тканей (целлюлиты, подкожные абсцессы, раневые инфекции (травматические или послеоперационные) и инфекции язв нижних конечностей (обычно у больных сахарным диабетом). Наряду с обычными микроорганизмами, встречающимися при целлюлитах и подкожных абсцессах (стафилококками, стрептококками), в настоящее время часто выделяют различные грамотрицательные микробы – Pseudomonas, Serratia, Enterobacter, Citrobacter, Acinetobacter и др. (нередко в ассоциациях и обладающих полирезистентностью к антибиотикам), лечение которых представляет большие трудности. Применение ципрофлоксацина, хорошо проникающего в ткани, позволяет успешно лечить эти тяжелые инфекции, к тому же по эффективности ципрофлоксацин не уступает цефалоспоринам 3 поколения (цефтазидиму и цефатоксиму) [10].
Получены хорошие результаты клинической эффективности применения ципрофлоксацина при абдоминальных инфекциях. Имеются сообщения, что при перитоните, абсцессах, холециститах, панкреатитах и других заболеваниях брюшной полости, вызванных E. Coli, клинический и бактериологический эффект получен более чем в 90% случаев [5].
Сепсис. Одна из самых серьезных и жизнеугрожающих инфекций. Следует отметить несколько препаратов с широким спектром и низким уровнем чувствитеьности. К ним относятся карбапенемы (имипенем, меропенем), цефалоспорины IV поколения (цефепим), фторхинолоны (ципрофлоксацин, офлоксацин) [10].
Ципрофлоксацин рекомендован для включения в качестве 3–го, 4–го или 5–го препарата при лечении туберкулеза (в комбинации с другими противотуберкулезными средствами). Особенно это важно в случаях лекарственно–устойчивых форм туберкулеза. Важным качеством является и хорошая переносимость препарата, он может сочетаться с противотуберкулезными препаратами и использоваться длительными курсами [5].
Ципрофлоксацин активен в отношении гонококков и неэффективен при генитальной негонококковой инфекции. Также он демонстрирует хорошую эффективность в отношении энтеропатогенных инфекций. Так, ципрофлоксацин хорошо себя зарекомендовал в отношении лечения шигилезов и сальмонеллезов. Ципрофлоксацин используют в качестве препарата резерва при лечении инфекций центральной нервной системы, когда стандартные антибактериальные препараты себя исчерпали. Больным СПИДом при поражении М. avium показано включение ципрофлоксацина в комплексную антибактериальную терапию, хотя эффективность такого лечения пока недостаточно высока.
Взаимодействия. Активность возрастает при сочетании с b–лактамными антибиотиками, аминогликозидами, ванкомицином, клиндамицином, метронидазолом. Исследования, проведенные с антацидами, содержащими ионы алюминия и магния, показали их выраженное влияние на всасывание фторхинолонов из желудочно–кишечного тракта. При этом степень выраженности изменений во всасывании была неоднозначной для разных препаратов группы ФХ. Применение антацидов, содержащих катионы металлов, особенно алюминия и магния, с фторхинолонами приводит к образованию хелатных комплексов, не обладающих антибактериальной активностью, в результате чего концентрации хинолона в организме могут снижаться до такого уровня, который может отразиться на результатах лечения, существенно снижая эффективность терапии. В связи с образованием хелатов у больных, которые получали ципрофлоксацин для лечения бактериурии и у которых были высокие концентрации магния в моче (или в результате приема антацидов, содержащих магний, или в результате приема диуретиков, повышающих экскрецию магния), можно не получить ожидаемого антибактериального действия хинолона [10]. Из–за того, что растворимость ципрофлоксацина снижается при щелочных значениях рН, может наблюдаться повышенное образование кристаллов в моче больных, получающих соли бикарбонатов и другие алкилирующие средства одновременно с хинолоном. Не отмечено образования кристаллов в кислой моче при приеме NH4Cl. Применение антагонистов Н2–рецепторов повышает рН желудка от 2,0 до 6,0. Растворимость фторхинолонов при этих значениях рН существенно снижается, омепразол не влияет на ФК ципрофлоксацина. Имеются сообщения о появлении у ряда больных судорог при одновременном использовании фторхинолонов и нестероидных противовоспалительных лекарственных средств. Пробенецид, азлоциллин увеличивают концентрацию в крови, так как являются ингибиторами транспортеров в почечных канальцах. Усиливает действие варфарина и других пероральных антикоагулянтов (удлиняет время кровотечения). Увеличивает нефротоксичность циклоспорина.
Побочные эффекты. Ципрофлоксацин хорошо переносится больными, побочные эффекты развиваются в 4–8% случаев и носят легкий и умеренный характер. Большинство побочных эффектов наблюдается со стороны ЖКТ (тошнота, рвота, диарея, холестатическая желтуха, особенно у больных с заболеваниями печени в анамнезе) – не более 5%, со стороны ЦНС отмечается гловокружение, головная боль, бессоница – около 1,5%, аллергические реакции встречаются в 1,4% случаев [5].
Противопоказания: псевдомембранозный колит; повышенная чувствительность к ципрофлоксацину или другим производным фторхинолонов. Что касается использования ципрофлоксацина у детей, беременных и лактирующих женщин, то эти ограничения в использовании фторхинолонов будут пересмотрены, т.к. за период более чем 15–летнего применения не выявлено у этой категории ни одного серьезного осложнения со стороны костно–хрящевой системы [5].
Заключение
Широкое применение ФХ связано с их:
1) антимикробной активностью (степень проникновения в микробную клетку, хорошая бактерицидная активность, сохранение антимикробного эффекта при минимальной подавляющей концентрации, постантибиотический эффект, способность накапливаться в клетках фагоцитарной системы, что важно для лечения возбудителей с внутриклеточной локализацией, медленное развитие устойчивости);
2) фармакокинетическими характеристиками (высокая биодоступность, хорошее проникновение в органы и ткани, создание высоких концентраций в очагах инфекций, низкое связывание с белками плазмы, медленное выведение из организма, что позволяет использовать двухкратный и даже однократный прием в сутки, элиминация как почечным, так и внепочечным путями, отсутствие кумуляции), в частности, препарат Ифиципро®ОД является ципрофлоксацином пролонгированного действия, что обеспечивает максимальный эффект препарата уже при однократном приеме и хорошую комплайнтность пациентов ;
3) высокой клинической эффективностью, хорошей переносимостью и низкой частотой развития побочных эффектов.
Все это делает фторхинолоны незаменимыми в арсенале врача общей практики. Однако не следует забывать о резистентности бактерий к ФХ. Имеются сообщения о повышении устойчивости к ФХ S. aureus и P. аeruginosa, поэтому назначение ФХ должно быть обоснованным.
Источник